Samenvatting
Multiple sclerose is waarschijnlijk een auto-immuunziekte, waarbij meervoudige littekenvorming in de hersenen ontstaat als gevolg van myelineafbraak. Eén van de potentiële oorzaken hiervan zijn humane endogene retrovirussen (HERV’s). Deze HERV’s komen in gezonde personen niet of nauwelijks tot expressie, maar zijn in diverse ziekten (waaronder in MS en een aantal andere auto-immuunziekten) verhoogd aangetroffen. Het immuunsysteem lijkt hierop te reageren, met pathogeniteit tot gevolg. Mogelijk is een omgevingstrigger, zoals een virus, verantwoordelijk voor de abnormale HERV-expressie.
Introductie
Multiple sclerose is een ziekte waarbij de witte stof (myeline) van de hersenen is aangedaan. Dit leidt tot tijdelijke en vaak ook blijvende neurologische uitvalsverschijnselen. De ziekte ontstaat op meerdere plaatsen (multiple) in de hersenen en leidt daar tot littekenvorming (sclerose). In Nederland leiden ongeveer 14.500 personen aan de ziekte; jaarlijks komen daar ongeveer 1800 personen bij (gegevens 2007).[4] Multiple sclerose is waarschijnlijk een auto-immuunziekte, waarbij antistoffen van de patiënt, gericht tegen een virus of andere stof uit de omgeving, reageren met myeline van het eigen lichaam. Myeline vormt een isolatielaagje om axonen (zenuwceluitlopers) in het zenuwstelsel en zorgt daar voor een snelle voortgeleiding van elektrische prikkels tussen hersencellen.[5]
De pathogenese van MS is na jaren van onderzoek nog steeds niet duidelijk. Dit reviewartikel richt zich op één van de potentiële oorzaken van MS: humane endogene retrovirussen.
Humane endogene retrovirussen
Retrovirussen
RNA tumorvirussen, tegenwoordig bekend als retrovirussen, werden als eerste ontdekt toen Payton Rous in 1911 een virus isoleerde uit kiptumoren.[6] In de jaren die volgde werd steeds meer bekend over de werking van deze groep virussen. Dat retrovirussen ook in mensen ziekte kunnen veroorzaken werd pas in de jaren ’80 bekend, met de ontdekking van het humaan T-cel lymfotrope virus (HTLV-I in 1980, HTLV-II in 1982) en het humaan immuundeficiëntievirus (HIV-I in 1983, HIV-II in 1986).[7]
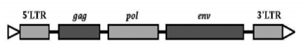
Figuur 1. Genoom van een retrovirus.[3]
Het genoom van een retrovirus (figuur 1) is 7-10 kilobasen lang en bestaat uit RNA met tenminste drie open reading frames (ORF) omsloten door twee long terminal repeats (LTR). De ORF’s bestaan uit: groep-specifiek antigeen (gag), dat codeert voor de kern- en structuureiwitten; polymerase (pol), dat codeert voor de enzymen reverse transcriptase, protease en integrase; en envelop (env), die codeert voor de oppervlakte antigenen. De LTR speelt een rol in de genexpressie. Sommige retrovirussen bezitten nog andere genen, vaak met als functie om het immuunsysteem te omzeilen.[8]
De meest karakteristieke eigenschap van retrovirussen is dat zij de enzymen reverse transcriptase en integrase gebruiken om respectievelijk viraal RNA om te zetten naar complementair DNA en dit vervolgens te integreren in het genoom van de gastheercel. Het retrovirale DNA wordt vanaf dat moment een provirus genoemd.[8]
Herkomst
Retrovirussen komen in twee vormen voor: exogeen of endogeen. Exogene retrovirussen infecteren gastheercellen via geschikte virusspecifieke receptoren. Wanneer een exogeen retrovirus een geslachtscel infecteert kan het ontstane provirus als onderdeel van het genoom worden doorgegeven aan de volgende generatie(s). Dit heet endogenisatie en het provirus wordt vanaf dat moment een endogeen retrovirus genoemd (ERV). ERV’s blijven door verticale transmissie (via Mendeliaanse overerving) generaties lang onderdeel van het genoom van de gastheer. Voor zover bekend kunnen ERV’s, in ieder geval in de mens, niet meer verspreiden door horizontale transmissie.[7,9]
Het eerste humane endogeen retrovirus (HERV) werd in 1981 ontdekt.[10] Al in de jaren ’60 werden genen gevonden die codeerden voor retrovirale genproducten, maar deze werden niet als HERV’s herkend. Met hybridisatietechnieken en de PCR werden steeds meer HERV’s gevonden, maar de precieze omvang van het aantal HERV’s in het menselijk genoom werd pas duidelijk door het human genome project, waarmee het volledige menselijk genoom in kaart is gebracht.[11] Daaruit bleek dat ongeveer 8% van het menselijk genoom bestaat uit HERV’s. Een ander deel van het DNA bestaat uit retrotransposons (endogene RNA-virussen die verwant, maar niet gelijk zijn aan retrovirussen), zoals short en long interspersed nuclear elements (SINEs en LINEs). Als we alle HERV fragmenten en afgeleiden, en de retrotransposons meetellen, stijgt het percentage DNA van virale oorsprong tot zelfs bijna de helft van het menselijk DNA (figuur 2). Tienduizenden HERV’s hebben hun genen volledig verloren en bestaan slechts nog uit grote hoeveelheden losse LTR’s. Andere HERV’s hebben nog intacte genen die kunnen coderen voor functionele gag-, pol of env-eiwitten.[12-14]

Figuur 2. Retrovirussen en fragmenten daarvan in het menselijk genoom.[3]
Niet alleen menselijk DNA bevat ERV’s, maar alle gewervelden en vrijwel alle eukaryoten. Door het genoom van primaten te vergelijken met het menselijk genoom kan worden nagegaan op welk moment in de evolutie een bepaalde ERV het genoom is binnengedrongen. Zo wordt ERV-W gevonden in Afrikaanse apen en de mens, maar niet in apen van de Nieuwe Wereld. Het meest recente HERV van het menselijk genoom is HERV-K113, dat zich op chromosoom 19 bevindt van slechts 29% van alle mensen, vooral van Afrikaanse, Aziatische en Polynesische afkomst. Dit HERV kan pas het menselijk genoom zijn binnengedrongen na de grote migratie uit Afrika, zeker minder dan 200.000 jaar geleden en waarschijnlijk nog veel recenter.[1,12,15]
Waarschijnlijk is elk ERV het resultaat van een retrovirale pandemie. Deze hypothese wordt “plague-culling” genoemd; retrovirale endogenisatie leidt tot immuniteit voor een normaal gesproken dodelijk virus, dus alleen individuen met het endogene retrovirus overleven de pandemie. Frank Ryan, een van de grondleggers van deze hypothese, heeft hier zelfs een term voor bedacht: virolutie.[14,16]
Classificatie
Fylogenetische analyses laten zien dat het humane genoom tenminste 31 verschillende groepen HERV’s bevat, variërend in aantallen van één tot vele duizenden. Soortgelijke verdelingen worden gezien in de genomen van andere soorten, zoals muizen en apen. De nomenclatuur en classificatie van ERV’s is niet eenduidig. In het begin werden endogene provirussen vooral vernoemd naar het meest verwante exogene retrovirus, zoals het murine leukemievirus (MLV). Tegenwoordig is het gebruikelijk om met een voorzetsel van één of twee letters aan te geven in welke soort een ERV oorspronkelijk ontdekt is; dus HERV voor endogene retrovirussen die voor het eerst zijn ontdekt in het menselijk genoom en MERV (of MuERV) voor endogene retrovirussen die voor het eerst zijn ontdekt in het muisgenoom. HERV’s worden verder nog onderverdeeld op basis van welke transfer-RNA (tRNA) aan de primer binding site bindt. Bijvoorbeeld HERV’s uit de HERV-K familie gebruiken hiervoor allen een Lysine (afgekort Lys of K) tRNA. Deze toevoeging zegt niets over hun onderlinge relatie. Verschillende HERV’s binnen één familie worden onderscheiden door een nummer toe te voegen aan de naam, duidend op de locatie van de HERV op het chromosoom.[13]
Symbiogenese
Sinds de jaren ’30 werd lange tijd aangenomen dat mutaties de enige verklaring zijn voor het ontstaan van de erfelijke basis van ziekten. In de afgelopen jaren is duidelijk geworden dat er nog andere evolutionaire mechanismen bestaan die een belangrijke rol spelen in erfelijke variatie. Eén daarvan is symbiogenese: symbiose als evolutionair mechanisme. Symbiose wordt omschreven als een significante interactie tussen verschillende levensvormen. Een symbiose dient niet te worden verward met mutualisme. Slechts één van de partners hoeft te profiteren van de relatie. Mutualisme, parasitisme en commensalisme zijn allen vormen van symbiosen.[14,17]
Het ontstaan van nieuwe pandemische griepvirussen is een bekend voorbeeld van symbiogenese. Het evolutionaire samenspel van retrovirussen en gewervelden duurt al tientallen, mogelijk honderden miljoenen jaren en is waarschijnlijk nog steeds aan de gang; in koala’s wordt dit momenteel onderzocht.[18]
Eerder werd duidelijk hoe HERV’s in het menselijk genoom terecht zijn gekomen. Aanvankelijk dacht men dat deze overblijfselen van oude retrovirale pandemieën geen functie meer hadden en daarom werden deze overblijfselen “junk-DNA” genoemd. Men kan zich afvragen waarom dit DNA bewaard is gebleven gedurende de evolutie. Immers zijn de pandemieën waartegen de HERV’s beschermden reeds lang verdwenen en weten we dat genen die geen evolutionair voordeel opleveren voor de soort op den duur weer zullen verdwijnen; het gaat hier immers om onnodige ballast voor het individu. Blijkbaar zijn HERV’s dus nog steeds voordelig voor de mens.[12-14]
Inmiddels zijn hier ook een aantal voorbeelden van bekend:
- HERV’s hebben mogelijk een sleutelrol gespeeld in het ontstaan van het immuunsysteem. Zo bevinden zich vele HERV’s en retro-elementen in het genoomgebied van het humane major histocompatibility complex (MHC).[19]
- Retrovirale env-eiwitten zorgen ervoor dat celmembranen in de placenta kunnen fuseren. Dit proces is nodig voor de ontwikkeling van placentaal syncytium, een essentieel onderdeel van de barrière die de bloedbanen van moeder en foetus scheidt.[14]
- Infectie met HIV zorgt voor expressie van HERV’s wat leidt tot een T-celrespons tegen HERV-antigenen. Deze T-cellen zullen vervolgens HIV-geïnfecteerde cellen opruimen.[20]
Deze voorbeelden zijn slecht het topje van de ijsberg en langzaam aan wordt steeds meer duidelijk over de rol die HERV’s spelen in het functioneren en de evolutie van de mens.[21]
Toch is er ook een keerzijde van de medaille; HERV-antigenen komen normaal gesproken niet of slechts in hele lage hoeveelheid tot expressie, maar in bijzondere omstandigheden waarin de gastheer deze genen niet langer kan reguleren, kan expressie van HERV-genen leiden tot pathologische processen. Er wordt gedacht dat triggers van buitenaf, zoals micro-organismen en stoffen uit het milieu, een abnormale HERV-expressie kunnen veroorzaken. Dit zou een mogelijke verklaring kunnen zijn voor het ontstaan van “moderne” ziekten, zoals auto-immuunziekten.[16]
Auto-immuunziekten
Midden jaren ’90 ontdekte onderzoekers dat patiënten met auto-immuunziekten antistoffen tegen retrovirussen in hun bloed hadden. Al snel werd duidelijk dat deze antistoffen niet gericht waren tegen exogene retrovirussen zoals HIV of HTLV, maar tegen HERV’s.[9]
HERV’s kunnen op tenminste twee manieren een abnormale immuunreactie opwekken. Ten eerste, gecodeerde HERV-eiwitten kunnen herkend worden als “lichaamsvreemd”; kruisreactieve antistoffen kunnen zo leiden tot auto-immuunziekten. Ten tweede, de LTR van een HERV kan een gen tot expressie brengen die normaal inactief is; dit gen kan vervolgens door het immuunsysteem worden herkend als “lichaamsvreemd”. Bepalen of abnormale HERV-expressie de oorzaak of het gevolg is van een ziekte kan erg lastig zijn. Abnormale expressie van HERV-genen wordt gezien in een aantal auto-immuunziekten, waaronder reumatoïde artritis, lupus erythematosus en het syndroom van Sjögren. HERV’s worden er ook van verdacht een rol te spelen in multiple sclerose.[16]
Multiple sclerose
MS-geassocieerd retrovirus
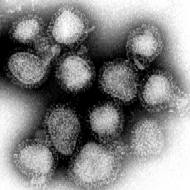
In 1997 ontdekte Perron en collega’s een nieuw retrovirus (MS-geassocieerd retrovirus; MSRV)[22], dat later werd herkend als een HERV uit de HERV-W familie. HERV-W is sinds dien geïsoleerd in de laesies van MS-patiënten en in patiënten met andere neurologische aandoeningen, maar ook in controles. Daar komt nog bij dat HERV-W ook tot expressie komt in normale cellen van het centrale zenuwstelsel (figuur 3). Toch is de expressie in MS-patiënten verhoogd (soms wel een 20 tot 25-voudige toename), zodat gedacht wordt dat HERV-W weldegelijk een rol speelt in MS.[23]
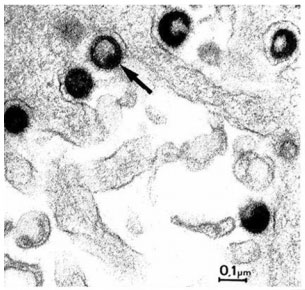
Figuur 3. Elektronmicroscopisch beeld van MSRV-virion
in leptomeningeale cellen (hersenvlies).[1]
Wanneer HERV-W wordt aangetroffen in het liquor van MS-patiënten correleert de “viral load” met de klinische progressie en prognose van de ziekte.1 MSRV is niet meer aantoonbaar in het bloed na drie maanden interferon-beta therapie, waaruit kan worden opgemaakt dat het virus een rol speelt in de pathogenese van MS.[24]
De potentiële pathogeniteit van (eiwitten van) MSRV is aangetoond in experimenten met muizen. Immuundeficiënte muizen met menselijke lymfocyten ontwikkelden na toediening van injectie met MSRV-virions acute neurologische symptomen en stierven.[25] Ook is aangetoond dat een medium van foetale menselijke astrocyten met HERV-W expressie cytotoxisch is voor mens- en rat-oligodendrocyten. De belangrijkste functie van oligodendrocyten is het myeliniseren van axonen (figuur 4).[26]
Perron en collega’s ontdekten in 2001 dat MSRV env-eiwitten ook als superantigeen kunnen voorkomen.[27]

Figuur 4. Oligodentrocyt myeliniseert een axon.[2]
Superantigenen zijn antigenen die in staat zijn een zeer sterke immuunreactie op te wekken, doordat zij direct binden aan MHC-klasse II-moleculen aan het oppervlak van de antigeenpresenterende cel. (voor een uitgebreide uitleg over superantigenen zie [28]). In vitro ontstond een abnormale T-celreactie tegen deze antigenen, die mogelijk ook in vivo voorkomt. Deze abnormale immuunreactie kan, doordat er ook auto-specifieke T-lymfocyten worden gevormd, leiden tot auto-immuniteit.
HERV-H en HERV-K
MSRV is niet de enige HERV die mogelijk een rol speelt in MS. In de leasies van MS-patiënten worden HERV-H en -K verhoogd aangetroffen. HERV-H-deeltjes worden bovendien aangetroffen in het plasma van MS-patiënten.[29,30] HERV-K-env is een riskfactor voor MS, maar wordt slecht aangetroffen in een subset MS-patiënten.[31] HERV-K is beschreven als een superantigeen en wordt geactiveerd door Epstein-Barrvirus in de pathogenese van diabetes type 1.[32] Toch is de rol van HERV-H en -K in MS minder uitvoerig onderzocht dan die van HERV-W, zodat nog niet gesproken kan worden van een mogelijke rol van de virussen in de pathogenese van MS.
Triggers
Het lijkt er dus op dat in ieder geval HERV-W een rol speelt de pathogenese van MS, maar een causaal verband is hiermee nog niet aangetoond. Gedacht wordt dat er een omgevingstrigger nodig is, mogelijk een virus, om HERV’s tot expressie te laten komen.[1]
In het geval van HERV-W is bekend dat virussen de reactivatie van het virus kunnen opwekken. Bovendien kunnen sommige virussen direct genen aan- en uitzetten, waaronder mogelijk ook HERV-genen. Virussen uit de herpesfamilie worden het vaakst in verband gebracht met HERV-W reactivatie.
Conclusie
HERV expressie kan het gevolg zijn van veranderingen in de cel, veroorzaakt door andere pathogene processen van een ziekte. Ook immuunreacties tegen HERV-producten kunnen hier het resultaat van zijn. Het is daarom lastig vast te stellen of HERV’s het gevolg of de oorzaak van MS zijn. Het lijkt erop dat in ieder geval HERV-W een belangrijke rol speelt in de pathogenese van MS. Voor HERV-H en -K is dit momenteel nog niet duidelijk. Toekomstig onderzoek gaat hierover waarschijnlijk uitsluitsel geven.
Referenties
- Perron, H. & Lang, A. The human endogenous retrovirus link between genes and environment in multiple sclerosis and in multifactorial diseases associating neuroinflammation. Clin Rev Allergy Immunol 39, 51-61 (2010).
- Andrew, C. Neuron with oligodendrocyte and myelin sheath. (Wikipedia Commons, 2010).
- Ryan, F.P. An alternative approach to medical genetics based on modern evolutionary biology. Part 2: retroviral symbiosis. J R Soc Med 102, 324-31 (2009).
- Gommer AM (RIVM), P.M.R. Multiple sclerose: prevalentie, incidentie en sterfte naar leeftijd en geslacht. in Nationaal Kompas Volksgezondheid (RIVM, Bilthoven, 2010).
- Hemert-van der Poel, J.C., Pol-Jacobs, I. & Booy, M. Multiple sclerose (MS). in Verpleegkundig Vademecum 446-450 (Bohn Stafleu van Loghum, 2008).
- Rous, P. A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells. J Exp Med 13, 397-411 (1911).
- Christensen, T. HERVs in neuropathogenesis. J Neuroimmune Pharmacol 5, 326-35 (2010).
- Telesnitsky, A. Retroviruses: Molecular Biology, Genomics and Pathogenesis. Future Virol 5, 539-543 (2010).
- Balada, E., Vilardell-Tarres, M. & Ordi-Ros, J. Implication of human endogenous retroviruses in the development of autoimmune diseases. Int Rev Immunol 29, 351-70 (2010).
- Martin, M.A., Bryan, T., Rasheed, S. & Khan, A.S. Identification and cloning of endogenous retroviral sequences present in human DNA. Proc Natl Acad Sci U S A 78, 4892-6 (1981).
- Lander, E.S. et al. Initial sequencing and analysis of the human genome. Nature 409, 860-921 (2001).
- Ryan, F.P. Human endogenous retroviruses in health and disease: a symbiotic perspective. J R Soc Med 97, 560-5 (2004).
- Stoye, J.P. Studies of endogenous retroviruses reveal a continuing evolutionary saga. Nat Rev Microbiol 10, 395-406 (2012).
- Roossinck, M.J. The good viruses: viral mutualistic symbioses. Nat Rev Microbiol 9, 99-108 (2011).
- Turner, G. et al. Insertional polymorphisms of full-length endogenous retroviruses in humans. Curr Biol 11, 1531-5 (2001).
- Krone, B. & Grange, J.M. Melanoma, Darwinian medicine and the inner world. J Cancer Res Clin Oncol 136, 1787-94 (2010).
- Ryan, F.P. An alternative approach to medical genetics based on modern evolutionary biology. Part 1: mutation and symbiogenesis. J R Soc Med 102, 272-7 (2009).
- Tarlinton, R., Meers, J. & Young, P. Biology and evolution of the endogenous koala retrovirus. Cell Mol Life Sci 65, 3413-21 (2008).
- Dawkins, R. et al. Genomics of the major histocompatibility complex: haplotypes, duplication, retroviruses and disease. Immunol Rev 167, 275-304 (1999).
- Garrison, K.E. et al. T cell responses to human endogenous retroviruses in HIV-1 infection. PLoS Pathog 3, e165 (2007).
- Hunter, P. The missing link. Viruses revise evolutionary theory. EMBO Rep 11, 28-31 (2010).
- Perron, H. et al. Molecular identification of a novel retrovirus repeatedly isolated from patients with multiple sclerosis. The Collaborative Research Group on Multiple Sclerosis. Proc Natl Acad Sci U S A 94, 7583-8 (1997).
- Ryan, F.P. An alternative approach to medical genetics based on modern evolutionary biology. Part 3: HERVs in diseases. J R Soc Med 102, 415-24 (2009).
- Mameli, G. et al. Inhibition of multiple-sclerosis-associated retrovirus as biomarker of interferon therapy. J Neurovirol 14, 73-7 (2008).
- Firouzi, R. et al. Multiple sclerosis-associated retrovirus particles cause T lymphocyte-dependent death with brain hemorrhage in humanized SCID mice model. J Neurovirol 9, 79-93 (2003).
- Antony, J.M. et al. Human endogenous retrovirus glycoprotein-mediated induction of redox reactants causes oligodendrocyte death and demyelination. Nat Neurosci 7, 1088-95 (2004).
- Perron, H. et al. Multiple sclerosis retrovirus particles and recombinant envelope trigger an abnormal immune response in vitro, by inducing polyclonal Vbeta16 T-lymphocyte activation. Virology 287, 321-32 (2001).
- Groeneveld, P.H. [The role of superantigens in infections]. Ned Tijdschr Geneeskd 138, 2235-8 (1994).
- Christensen, T. Association of human endogenous retroviruses with multiple sclerosis and possible interactions with herpes viruses. Rev Med Virol 15, 179-211 (2005).
- Johnston, J.B. et al. Monocyte activation and differentiation augment human endogenous retrovirus expression: implications for inflammatory brain diseases. Ann Neurol 50, 434-42 (2001).
- Armbruester, V. et al. A novel gene from the human endogenous retrovirus K expressed in transformed cells. Clin Cancer Res 8, 1800-7 (2002).
- Conrad, B. et al. A human endogenous retroviral superantigen as candidate autoimmune gene in type I diabetes. Cell 90, 303-13 (1997).
Bovenstaand artikel is geschreven door Ronnie Schuurbiers in het kader van de minor Disciplines Applied Science van de Fontys Hogescholen. Deze tekst mag in geen geval zonder uitdrukkelijke toestemming worden verspreid.
No Comments