Samenvatting
 In 2006 werd een nieuw menselijk retrovirus genaamd xenotroop murine leukemievirus-gerelateerd virus (XMRV) in verband gebracht met erfelijke prostaatkanker. In 2009 en 2010 werd dit virus in twee aparte studies ook aangetoond in het bloed van personen met het chronische vermoeidheidssyndroom. Een groot aantal andere studies wist deze bevindingen echter niet te repliceren, zodat al snel werd vermoed dat de bevindingen misschien het gevolg waren van contaminatie. In 2011 werd ontdekt dat XRMV afkomstig is van een recombinatie tussen verschillende stukken endogene provirussen tijdens de xenotransplantatie van prostaatkankertumorweefsel in muizen. Vanuit dit weefsel is een cellijn geproduceerd, wat waarschijnlijk de bron is van de besmetting.
In 2006 werd een nieuw menselijk retrovirus genaamd xenotroop murine leukemievirus-gerelateerd virus (XMRV) in verband gebracht met erfelijke prostaatkanker. In 2009 en 2010 werd dit virus in twee aparte studies ook aangetoond in het bloed van personen met het chronische vermoeidheidssyndroom. Een groot aantal andere studies wist deze bevindingen echter niet te repliceren, zodat al snel werd vermoed dat de bevindingen misschien het gevolg waren van contaminatie. In 2011 werd ontdekt dat XRMV afkomstig is van een recombinatie tussen verschillende stukken endogene provirussen tijdens de xenotransplantatie van prostaatkankertumorweefsel in muizen. Vanuit dit weefsel is een cellijn geproduceerd, wat waarschijnlijk de bron is van de besmetting.
Abstract
In 2006, a novel retrovirus named xenotopic murine leukemia virus-related virus (XMRV) was associated with hereditary prostate cancer. In 2009 and 2010 in two separate studies this virus was also found in the blood of patients with chronic fatigue syndrome. A large number of other studies could not replicate these findings, so that soon there was suspicion that possibly the findings were the result of contamination. In 2011 it was discovered that XMRV originated from a recombination event between several parts of endogenous proviruses during a xenotransplantation of prostate cancer tumor tissue in mice. From this tissue a cell line was produced, which is probably the source of the contamination. Article in Dutch.
1. Inleiding
Virussen kunnen in mensen en dieren een groot aantal ziekten veroorzaken, zoals verkoudheid en griep, maar ook ernstigere ziekten zoals kanker [1]. Op dit moment zijn er zeven zogeheten oncovirussen bekend die kanker kunnen veroorzaken bij de mens: Epstein-Barrvirus (o.a. lymfomen), hepatitis B en C (leverkanker), humane T-lymphotrofe virus (o.a. leukemie), humaan herpesvirus-8 (kaposisarcoom), humaan papillomavirus (o.a. baarmoederhalskanker) en merkelcelpolyomavirus (merkelcelcarcinoom). Enkele andere virussen zijn ook in verband gebracht met kanker, zoals bijvoorbeeld het muis-mammatumorvirus (borstkanker), maar definitief bewijs ontbreekt nog [2, 3]. Een belangrijk doel van de medische wetenschap is het ontdekken van de rol die virussen spelen in het ontstaan van ziekten, in het bijzonder kanker, zodat behandel- en preventiemethoden kunnen worden ontwikkeld. De ontdekking in het begin van de jaren 1980 dat het humaan immuundeficiëntievirus de veroorzaker is van AIDS heeft ervoor gezorgd dat vooral de rol van retrovirussen in ziekten uitvoerig wordt onderzocht. Ondanks steeds gevoeligere technieken, met name de PCR techniek, blijft het lastig om nieuwe retrovirussen in verband te brengen met ziekten. Belangrijkste reden hiervoor is dat retrovirussen onderdeel uitmaken van het DNA van mens en dieren (zie hoofdstuk 2). Dit heeft in het verleden meer dan eens geleid tot controverse onder virologen, zodat de vondst van een nieuw retrovirus bij een humane ziekte vaak al snel worden afgedaan als een “human rumor virus”. Het is daarom van groot belang dat de vermeende rol van een virus in een ziekte uitvoerig wordt onderzocht [4].
In 2006 werd een nieuw retrovirus, het xenotroop murine leukemie-gerelateerd virus (XMRV), in verband gebracht met erfelijke prostaatkanker. Drie jaar later werd ditzelfde virus gevonden bij personen met het chronische vermoeidheidssyndroom (CVS). Sindsdien zijn beide studies steeds vaker in twijfel getrokken. Men vermoedde dat het gevonden virus afkomstig was uit een besmette cellijn. Deze literatuurscriptie onderzoekt de herkomst van XMRV en de mogelijkheid of XMRV een rol speelt in prostaatkanker of CVS.
2. Endogene murine leukemievirussen.
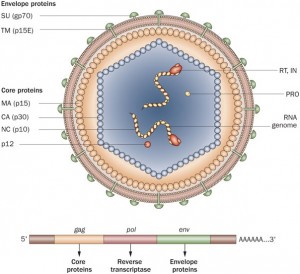
Retrovirussen hebben als unieke eigenschap het vermogen om, als onderdeel van hun replicatie, te integreren in het genoom van de gastheercel [5]. Door het infecteren van cellen van het voortplantingssysteem kan een exogeen retrovirus permanent onderdeel worden van het DNA van de gastheer. Dit wordt dan een endogeen provirus genoemd. Alle gewervelde dieren en de mens dragen sporen van zulke infecties in hun DNA [5, 6]. In mensen bestaat zelfs 8% van het totale genoom uit retrovirale infecties, waarbij de laatste ongeveer honderdduizend jaar geleden heeft plaatsgevonden. Muisgenomen bevatten een groot aantal recentere endogene provirussen. Eén van de best onderzochte retrovirussen zijn de murine leukemie virussen (MLVs). Deze groep virussen komt zowel endogeen (als onderdeel van het genoom) als exogeen (als levend virus) voor, waarbij sommige exogene MLVs kanker kunnen veroorzaken in muizen [7, 8]. Op basis van het type cel dat kan worden geïnfecteerd worden MLVs ingedeeld in ecotrope, xenotrope en polytrope MLVs. Ecotrope virussen zijn virussen die in een beperkt aantal cellen kunnen repliceren, bijvoorbeeld wel in een humane cellijn, maar niet in een mens. Xenotrope virussen zijn in staat te repliceren in een ander organismen dan waar het uit afkomstig is. Polytrope virussen zijn in staat om te repliceren in het organismen waar het uit afkomstig is en in tenminste één ander organisme [5, 9].
3. De ontdekking van een nieuw retrovirus.
3.1 Erfelijke prostaatkanker
Prostaatkanker is momenteel de meest voorkomende vorm van kanker onder Europese mannen. Een aantal genen zijn aangemerkt als mogelijke risicofactor voor het ontwikkelen van prostaatkanker, waaronder het RNase-L gen. Een variant van dit gen, het R462Q single nucleotide polymorfisme, werd in verband gebracht met 13% van alle gevallen van erfelijke prostaatkanker [10]. Het enzym endoribonuclease-L waar dit gen voor codeert speelt een belangrijke rol in de antivirale activiteit van interferon; het enzym vernietigt RNA in een poging virale expressie tegen te gaan. Het vermoeden bestaat daarom dat een virus een belangrijke rol kan spelen in het ontstaan van erfelijke prostaatkanker [11, 12]. In 2006 zochten Urisman et al. [13] naar virussen in personen, homozygoot met mutatie R462Q, met erfelijke prostaatkanker. In 40% van onderzochte tumorweefsels werd het genoom van een nieuw gammaretrovirus gevonden. Dit virus bleek nauw verwant aan het xenotroop murine leukemievirus (MLV) en werd om die reden xenotroop murine leukemievirus-gerelateerd virus genoemd [13]. Vervolgstudies door andere groepen konden echter geen verband aantonen tussen het virus en erfelijke prostaatkanker [14, 15].
3.2 Het chronische vermoeidheidssyndroom
CVS is een ziekte die vaak ontstaat na een virale infectie, maar de precieze oorzaak is tot op heden onbekend [16]. In het verleden zijn diverse virussen (o.a. enterovirussen [17], herpesvirussen [18] en HTLV-II [19]) in verband gebracht met CVS, maar een oorzakelijk verband kon nooit worden vastgesteld. Desondanks wordt de rol van een virus in CVS niet uitgesloten. Eén van de redenen hiervoor is dat, net als bij erfelijke prostaatkanker, veranderingen in de werking van het RNase-L-gen in verband zijn gebracht met CVS [20, 21].
In 2009 werd XMRV gevonden in het bloed van 67/101 CVS-patiënten en 8/218 gezonde personen [22]. Ook hier konden vervolgstudies door andere groepen geen MLV-gerelateerde genetische sequenties vinden [23-25]. Halverwege 2010 verscheen er toch weer een studie met positieve resultaten. Lo et al. [26] vonden echter virale sequenties die meer lijken op polytrope MLV-gerelateerde virussen. Of deze sequenties aantonen dat XMRV een grote genetische variatie kent of afkomstig zijn van een geheel ander virus en slechts nauw verwant zijn aan XMRV was niet duidelijk.
Als mogelijke redenen voor de grote verschillen tussen de diverse onderzoeken werden onder andere genoemd: de geografische verspreiding van het virus, de diversiteit in sequenties van de virusstammen, het gebruik van verschillende bepalingsmethoden, het verschil in selectie van patiëntenmonsters en contaminatie. Vooral deze laatste mogelijkheid werd uitgebreid onderzocht. Er werd aangetoond dat patiëntenmonsters en reagentia eenvoudig gecontamineerd kunnen raken met muis-DNA, en daarmee met endogene provirussen. De diverse studies zouden dus mogelijk sequenties van endogene provirussen gevonden hebben. Op dat moment ontbrak echter direct bewijs dat hier inderdaad sprake van zou zijn geweest [27-31].
In een poging het vermeende verband tussen XMRV en chronisch vermoeidheidssyndroom te bevestigen (en dus contaminatie uit te sluiten) besloot het Amerikaanse ministerie van gezondheid een tweetal blinde studies uit te voeren. De eerste studie toonde aan dat de gebruikte XMRV bepalingsmethoden uit de Lombardi et al. studie geen reproduceerbare resultaten opleverden [32]. Bovendien werd gelijktijdig met het verschijnen van deze studie een “partial retraction” gepubliceerd, waarin Lombardi et al. een deel van hun studie introkken, omdat er sprake zou zijn van contaminatie in een aantal van de monsters [33]. Het gaat hier om monsters die in het laboratorium van Silverman zijn onderzocht, wat mogelijk ook de prostaatkankerstudie in twijfel trekt. De resultaten van de tweede blinde studie worden begin 2012 verwacht.
4. De oorsprong van XMRV
 XMRV kent een grote gelijkenis in sequentie met endogene MLV provirussen [13]. XRMV deelt dus waarschijnlijk eenzelfde oorsprong met deze provirussen, maar is wel een op zichzelf staand virus met een eigen plaats in de fylogenetische stamboom. In 1992 werd van humaan prostaatkankerweefsel een xenograft gemaakt, genaamd CWR22. Van deze xenograft werd in 1998 een cellijn ontwikkelt [34]. Deze cellijn, 22Rv1 genaamd, produceert infectueuze XMRV met vrijwel identieke sequenties als die gevonden in patiënten in de Urisman- en Lombardi-studies [35]. Het vermoeden bestond daarom dat XMRV afkomstig was uit een besmette tumor of kon zijn ontstaan tijdens de xenotransplantatie van menselijk prostaatkanker tumorweefsel in laboratoriummuizen. Paprotka et al. [36] onderzochten deze mogelijkheden. In xenograftmonsters van voor 1993 kon geen XMRV worden gevonden; de originele tumor kon dus geen XMRV bevatten. In xenograftmonsters van na 1996 werd wel XMRV gevonden. Bovendien vonden ook zij XMRV in de 22Rv1 cellijn. Ergens tussen 1993 en 1996 zou XMRV dus waarschijnlijk zijn ontstaan tijdens een recombinatie in laboratoriummuizen, om zodoende te zijn overgedragen naar de 22Rv1 cellijn. Hoewel XMRV niet als compleet endogeen retrovirus in de onderzochte muizenstammen kon worden gevonden, ontdekte men wel twee provirussen (PreXMRV-1 en -2) die samen kunnen recombineren tot een virus dat vrijwel identiek is aan XMRV. Uit een gegenereerde fylogenetische stamboom blijkt dat PreXMRV-1 zich in de groep bevindt met xenotrope endogene MLVs, terwijl PreXMRV-2 zich in de groep bevindt met polytrope MLVs. Hoewel bovenstaande bevindingen een goede verklaring zijn van de oorsprong van XMRV uit de studies van Urisman et al. en Lombardi et al. verklaren zij nog niet de door Lo et al. gevonden polytrope MLV-gerelateerde virussequenties. In een reviewstudie door Cingöz en Coffin [37] wordt echter geopperd dat de gevonden sequenties in de Lo- studie mogelijk het resultaat zijn van contaminatie met muis-DNA.
XMRV kent een grote gelijkenis in sequentie met endogene MLV provirussen [13]. XRMV deelt dus waarschijnlijk eenzelfde oorsprong met deze provirussen, maar is wel een op zichzelf staand virus met een eigen plaats in de fylogenetische stamboom. In 1992 werd van humaan prostaatkankerweefsel een xenograft gemaakt, genaamd CWR22. Van deze xenograft werd in 1998 een cellijn ontwikkelt [34]. Deze cellijn, 22Rv1 genaamd, produceert infectueuze XMRV met vrijwel identieke sequenties als die gevonden in patiënten in de Urisman- en Lombardi-studies [35]. Het vermoeden bestond daarom dat XMRV afkomstig was uit een besmette tumor of kon zijn ontstaan tijdens de xenotransplantatie van menselijk prostaatkanker tumorweefsel in laboratoriummuizen. Paprotka et al. [36] onderzochten deze mogelijkheden. In xenograftmonsters van voor 1993 kon geen XMRV worden gevonden; de originele tumor kon dus geen XMRV bevatten. In xenograftmonsters van na 1996 werd wel XMRV gevonden. Bovendien vonden ook zij XMRV in de 22Rv1 cellijn. Ergens tussen 1993 en 1996 zou XMRV dus waarschijnlijk zijn ontstaan tijdens een recombinatie in laboratoriummuizen, om zodoende te zijn overgedragen naar de 22Rv1 cellijn. Hoewel XMRV niet als compleet endogeen retrovirus in de onderzochte muizenstammen kon worden gevonden, ontdekte men wel twee provirussen (PreXMRV-1 en -2) die samen kunnen recombineren tot een virus dat vrijwel identiek is aan XMRV. Uit een gegenereerde fylogenetische stamboom blijkt dat PreXMRV-1 zich in de groep bevindt met xenotrope endogene MLVs, terwijl PreXMRV-2 zich in de groep bevindt met polytrope MLVs. Hoewel bovenstaande bevindingen een goede verklaring zijn van de oorsprong van XMRV uit de studies van Urisman et al. en Lombardi et al. verklaren zij nog niet de door Lo et al. gevonden polytrope MLV-gerelateerde virussequenties. In een reviewstudie door Cingöz en Coffin [37] wordt echter geopperd dat de gevonden sequenties in de Lo- studie mogelijk het resultaat zijn van contaminatie met muis-DNA.
5. De fylogenetische stamboom en XMRV
5.1 Multiple sequence alignment en de fylogenetische stamboom
Fylogenie is de wetenschap naar de ontstaansgeschiedenis en diversiteit van (groepen) organismen. Het basisprincipe hierachter is dat “de oorsprong van gelijkenis een gemeenschappelijke voorouder is”. Eén van de technieken die hierbij gebruikt wordt is het genereren van een fylogenetische stamboom aan de hand van multiple sequence alignments. Deze techniek wordt onder andere gebruikt om de oorsprong van virussen te onderzoeken. Aan de hand van complete of incomplete virusgenomen kan de mate van homologie (overeenkomst in sequentie) worden bepaald en zodoende de plaats in de fylogenetische stamboom [38]. Het meest gebruikte computerprogramma voor multiple sequence alignments is ClustalW, voor het eerst uitgebracht in 1988. De multiple sequence alignment wordt met behulp van diverse algoritmen geleidelijk opgebouwd door middel van een reeks pairwise alignments, met daaropvolgend de juiste vertakkingen in een guided tree [39]. Aan de hand van deze data kan vervolgens kan een fylogenetische stamboom worden gemaakt.
5.2 De plaats van XMRV in de fylogenetische stamboom
Hoewel diverse studies grote fylogenetische stambomen tonen met een veelvoud aan endogene en exogene MLVs, zijn slechte enkele sequenties van volledige genomen publiekelijk beschikbaar via GenBank. Van deze sequenties en de sequenties van de beschikbare XMRV genomen is met behulp van ClustalW een fylogenetische stamboom gemaakt (zie figuur 1).
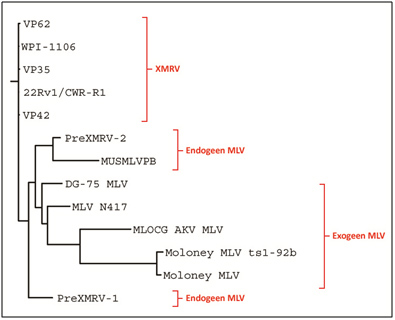
Figuur 1. Fylogenetische stamboom van XMRV en verwante endogene en exogene MLVs. De “XMRV-groep” bestaat uit sequenties afkomstig uit studies van Urisman et al. (VP35, VP42, VP62), Lombardi et al. (WPI-1106) en Paprotka et al. (22Rv1/CRW-R1). Deze laatste is afkomstig uit een door XMRV besmette cellijn [40]. De sequenties PreXMRV-1 en -2 zijn afkomstig uit de eerder besproken studie van Prapotka et al. De sequentie MUSMLVPB is van een endogeen MLV. De overige sequenties zijn van exogene MLVs.
In figuur 1 is duidelijk te zien dat de XMRV sequenties een aparte groep vormen. PreXMRV-2 vormt een groep met de enige beschikbare endogene MLV. De exogene MLVs vormen duidelijk aparte groepen.
Via het computerprogramma PhylipDistanceMatrix is aan de hand van de multiple sequence alignment data een similarity table gegenereerd. Hieruit blijkt dat de sequenties binnen de XMRV-groep voor ongeveer 99% identiek zijn aan elkaar, ongeveer 88% identiek zijn aan de enige beschikbare endogene MLV sequentie en 79-93% identiek zijn aan de exogene MLV sequenties.
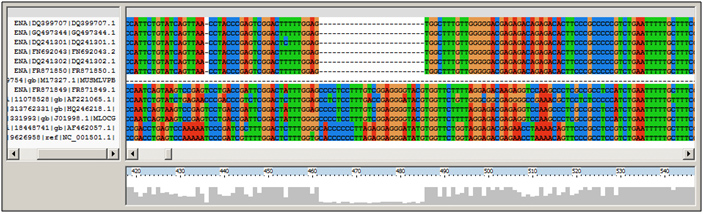
Figuur2. Deze multiple sequence alignment in ClustalW toont een duidelijk verschil tussen de “XRMV-groep” (eerste 6 sequenties) en de overige sequenties. De XMRV-sequenties missen allemaal dezelfde reeks nucleotiden. Bovendien is te zien dat de XMRV-sequenties vrijwel identiek zijn aan elkaar, terwijl de overige sequenties meer onderlinge verschillen kennen.
Ook in de sequenties zijn duidelijk verschillen op te merken tussen de “XRMV-groep” en de overige virussen. Zo zijn er op verschillende plaatsen “gaps” die wel in de sequenties van de “XMRV-groep” voorkomen, maar niet in de overige sequenties (zie figuur 2).
Conclusie
Het xenotroop murine leukemie-gerelateerd virus (XMRV) is de afgelopen jaren in een aantal studies in verband gebracht met prostaatkanker en het chronisch vermoeidheidssyndroom. Vervolgstudies wisten dit verband echter niet te bevestigen en bovendien werd aangetoond dat er sprake was van contaminatie van in ieder geval een aantal monsters. XMRV is een virus dat naar alle waarschijnlijkheid is ontstaan tijdens een recombinatie van twee endogene murine leukemievirussen in een laboratorium ergens tussen 1993 en 1996. Dit virus heeft vervolgens cellijnen en waarschijnlijk ook monsters besmet in verschillende laboratoria. Als gevolg daarvan hebben diverse onderzoeksgroepen waarschijnlijk onterecht een verband getrokken tussen het virus en beide ziektes. Ook contaminatie met muis-DNA, afkomstig uit reagentia, speelt daarbij mogelijk een rol.
Referenties
- Rous, P., A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells. J Exp Med, 1911. 13(4): p. 397-411.
- Fan, H., A new human retrovirus associated with prostate cancer. Proc Natl Acad Sci U S A, 2007. 104(5): p. 1449-50.
- Pagano, J.S., et al., Infectious agents and cancer: criteria for a causal relation. Semin Cancer Biol, 2004. 14(6): p. 453-71.
- Voisset, C., R.A. Weiss, and D.J. Griffiths, Human RNA “rumor” viruses: the search for novel human retroviruses in chronic disease. Microbiol Mol Biol Rev, 2008. 72(1): p. 157-96, table of contents.
- Coffin, J.M., S.H. Hughes, and H. Varmus, Retroviruses. 1997, Plainview, N.Y.: Cold Spring Harbor Laboratory Press. xv, 843 p.
- Herniou, E., et al., Retroviral diversity and distribution in vertebrates. J Virol, 1998. 72(7): p. 5955-66.
- Tomonaga, K. and J.M. Coffin, Structures of endogenous nonecotropic murine leukemia virus (MLV) long terminal repeats in wild mice: implication for evolution of MLVs. J Virol, 1999. 73(5): p. 4327-40.
- Stocking, C. and C.A. Kozak, Murine endogenous retroviruses. Cell Mol Life Sci, 2008. 65(21): p. 3383-98.
- Stoye, J.P. and J.M. Coffin, The four classes of endogenous murine leukemia virus: structural relationships and potential for recombination. J Virol, 1987. 61(9): p. 2659-69.
- Larson, B.T., et al., Pathological aggressiveness of prostatic carcinomas related to RNASEL R462Q allelic variants. J Urol, 2008. 179(4): p. 1344-8.
- Silverman, R.H., A scientific journey through the 2-5A/RNase L system. Cytokine Growth Factor Rev, 2007. 18(5-6): p. 381-8.
- Silverman, R.H., Implications for RNase L in prostate cancer biology. Biochemistry, 2003. 42(7): p. 1805-12.
- Urisman, A., et al., Identification of a novel Gammaretrovirus in prostate tumors of patients homozygous for R462Q RNASEL variant. PLoS Pathog, 2006. 2(3): p. e25.
- Fischer, N., et al., Prevalence of human gammaretrovirus XMRV in sporadic prostate cancer. J Clin Virol, 2008. 43(3): p. 277-83.
- Hohn, O., et al., Lack of evidence for xenotropic murine leukemia virus-related virus(XMRV) in German prostate cancer patients. Retrovirology, 2009. 6: p. 92.
- Holgate, S.T., et al., Chronic fatigue syndrome: understanding a complex illness. Nat Rev Neurosci, 2011. 12(9): p. 539-44.
- Dalakas, M.C., Enteroviruses in chronic fatigue syndrome: “now you see them, now you don’t”. J Neurol Neurosurg Psychiatry, 2003. 74(10): p. 1361-2.
- Soto, N.E. and S.E. Straus, Chronic Fatigue Syndrome and Herpesviruses: the Fading Evidence. Herpes, 2000. 7(2): p. 46-50.
- Ablashi, D.V., Viral studies of chronic fatigue syndrome. Clin Infect Dis, 1994. 18 Suppl 1: p. S130-3.
- Suhadolnik, R.J., et al., Upregulation of the 2-5A synthetase/RNase L antiviral pathway associated with chronic fatigue syndrome. Clin Infect Dis, 1994. 18 Suppl 1: p. S96-104.
- Suhadolnik, R.J., et al., Changes in the 2-5A synthetase/RNase L antiviral pathway in a controlled clinical trial with poly(I)-poly(C12U) in chronic fatigue syndrome. In Vivo, 1994. 8(4): p. 599-604.
- Lombardi, V.C., et al., Detection of an infectious retrovirus, XMRV, in blood cells of patients with chronic fatigue syndrome. Science, 2009. 326(5952): p. 585-9.
- Switzer, W.M., et al., Absence of evidence of xenotropic murine leukemia virus-related virus infection in persons with chronic fatigue syndrome and healthy controls in the United States. Retrovirology, 2010. 7: p. 57.
- Erlwein, O., et al., Failure to detect the novel retrovirus XMRV in chronic fatigue syndrome. PLoS One, 2010. 5(1): p. e8519.
- Groom, H.C., et al., Absence of xenotropic murine leukaemia virus-related virus in UK patients with chronic fatigue syndrome. Retrovirology, 2010. 7: p. 10.
- Lo, S.C., et al., Detection of MLV-related virus gene sequences in blood of patients with chronic fatigue syndrome and healthy blood donors. Proc Natl Acad Sci U S A, 2010. 107(36): p. 15874-9.
- Smith, R.A., Contamination of clinical specimens with MLV-encoding nucleic acids: implications for XMRV and other candidate human retroviruses. Retrovirology, 2010. 7: p. 112.
- Hue, S., et al., Disease-associated XMRV sequences are consistent with laboratory contamination. Retrovirology, 2010. 7(1): p. 111.
- Sato, E., R.A. Furuta, and T. Miyazawa, An endogenous murine leukemia viral genome contaminant in a commercial RT-PCR kit is amplified using standard primers for XMRV. Retrovirology, 2010. 7: p. 110.
- Oakes, B., et al., Contamination of human DNA samples with mouse DNA can lead to false detection of XMRV-like sequences. Retrovirology, 2010. 7: p. 109.
- Robinson, M.J., et al., Mouse DNA contamination in human tissue tested for XMRV. Retrovirology, 2010. 7: p. 108.
- Simmons, G., et al., Failure to Confirm XMRV/MLVs in the Blood of Patients with Chronic Fatigue Syndrome: A Multi-Laboratory Study. Science, 2011.
- Silverman, R.H., et al., Partial Retraction. Science, 2011.
- Sramkoski, R.M., et al., A new human prostate carcinoma cell line, 22Rv1. In Vitro Cell Dev Biol Anim, 1999. 35(7): p. 403-9.
- Knouf, E.C., et al., Multiple integrated copies and high-level production of the human retrovirus XMRV (xenotropic murine leukemia virus-related virus) from 22Rv1 prostate carcinoma cells. J Virol, 2009. 83(14): p. 7353-6.
- Paprotka, T., et al., Recombinant origin of the retrovirus XMRV. Science, 2011. 333(6038): p. 97-101.
- Cingöz, O. and J.M. Coffin, Endogenous Murine Leukemia Viruses: Relationship to XMRV and Related Sequences Detected in Human DNA Samples. Advances in Virology, 2011. in press.
- Lesk, A.M., Introduction to bioinformatics. 2nd ed. 2005, Oxford ; New York: Oxford University Press. xviii, 360 p., x p. of plates.
- Chenna, R., et al., Multiple sequence alignment with the Clustal series of programs. Nucleic Acids Res, 2003. 31(13): p. 3497-500.
- Paprotka, T., et al., Inhibition of xenotropic murine leukemia virus-related virus by APOBEC3 proteins and antiviral drugs. J Virol, 2010. 84(11): p. 5719-29.
Bovenstaand artikel is geschreven door Ronnie Schuurbiers in het kader van de minor Disciplines Applied Science van de Fontys Hogescholen. Deze tekst mag in geen geval zonder uitdrukkelijke toestemming worden verspreid.


No Comments