Samenvatting
Influenza (griep) is een overdraagbare ziekte, veroorzaakt door het influenzavirus. In gebieden met een gematigd klimaat komt het influenzavirus vooral voor in de koudere maanden. Met tussenpozen van 10 – 40 jaar komen wereldwijde pandemieën voor. Er bestaan veel verschillende soorten influenzavirussen, die continue aan verandering onderhevig zijn, zodat jaarlijks nieuwe vaccins nodig zijn om de bevolking te beschermen.
De huidige generatie influenzavirusvaccins worden geproduceerd in kippeneieren. Het productieproces begint bij het selecteren van de drie beste kandidaat-virusstrengen. Vervolgens worden deze virussen vermengd met een verzwakte influenzavirusstreng. De geselecteerde streng wordt daarna op grote schaal in kippeneieren gekweekt en achtereenvolgens geoogst, geconcentreerd en gefiltreerd.
Inleiding
Influenza
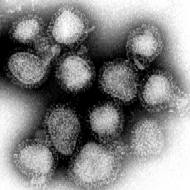 Influenza (griep) is een overdraagbare ziekte, veroorzaakt door het influenzavirus. Dit virus infecteert de luchtwegen en zorgt voor een aantal kenmerkende symptomen zoals koorts, hoofdpijn, hoesten, keelpijn, spierpijn, verstopte neus, gevoel van zwakte en verliest van eetlust.[1] Elk jaar krijgen ongeveer 820.000 Nederlanders griep. Tijdens een gemiddelde influenza-epidemie sterven er 250 – 2000 personen, direct of aan de gevolgen ervan, waarvan 90% in de leeftijd van 65 jaar en ouder.[2]
Influenza (griep) is een overdraagbare ziekte, veroorzaakt door het influenzavirus. Dit virus infecteert de luchtwegen en zorgt voor een aantal kenmerkende symptomen zoals koorts, hoofdpijn, hoesten, keelpijn, spierpijn, verstopte neus, gevoel van zwakte en verliest van eetlust.[1] Elk jaar krijgen ongeveer 820.000 Nederlanders griep. Tijdens een gemiddelde influenza-epidemie sterven er 250 – 2000 personen, direct of aan de gevolgen ervan, waarvan 90% in de leeftijd van 65 jaar en ouder.[2]
Influenza is een seizoensgebonden epidemische ziekte die in gebieden met een gematigd klimaat vooral in de koudere maanden de kop op steekt. Ook komen met tussenpozen van 10 – 40 jaar wereldwijde pandemieën voor.[3]
Variatie
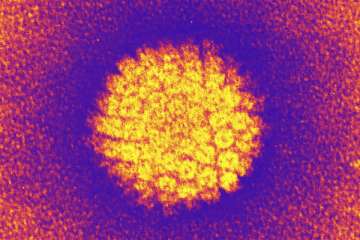
 Influenzavirus is een RNA-virus, dat behoort tot de familie orthomyxoviridae. De mens kan geïnfecteerd worden door drie verschillende influenzavirussen: A, B en C. Influenza A veroorzaakt regelmatige uitbraken – vooral pandemieën – en besmet ook vee en vogels. Influenza B veroorzaakt sporadische uitbraken in vooral risicogroepen, bijvoorbeeld in verzorgingshuizen. Influenza C is wijdverspreid, maar leidt niet vaak tot symptomen. Het genetisch materiaal bevindt zich in het nucleocapside en bestaat uit enkelstrengig gefragmenteerd RNA. Het nucleocapside is omgeven door een envelop waarop twee soorten glucoproteïne-uitsteeksels (oppervlakte-antigenen) bevinden: hemagglutinine (H of HA) en neuramidase (N of NA). Er zijn 16 N en 9 H subtypen bekend, maar slechts H1, H2 en H3, en N1 en N2 worden regelmatig aangetroffen in de mens.
Influenzavirus is een RNA-virus, dat behoort tot de familie orthomyxoviridae. De mens kan geïnfecteerd worden door drie verschillende influenzavirussen: A, B en C. Influenza A veroorzaakt regelmatige uitbraken – vooral pandemieën – en besmet ook vee en vogels. Influenza B veroorzaakt sporadische uitbraken in vooral risicogroepen, bijvoorbeeld in verzorgingshuizen. Influenza C is wijdverspreid, maar leidt niet vaak tot symptomen. Het genetisch materiaal bevindt zich in het nucleocapside en bestaat uit enkelstrengig gefragmenteerd RNA. Het nucleocapside is omgeven door een envelop waarop twee soorten glucoproteïne-uitsteeksels (oppervlakte-antigenen) bevinden: hemagglutinine (H of HA) en neuramidase (N of NA). Er zijn 16 N en 9 H subtypen bekend, maar slechts H1, H2 en H3, en N1 en N2 worden regelmatig aangetroffen in de mens.
Influenzavirussen worden elk jaar onderscheiden op basis van type, plaats van oorsprong, rangnummer, jaar van voorkomen en (tussen haakjes) subtype van beide oppervlakte-antigenen. Een voorbeeld is de Hong Kong-griep met de naam A/Hong Kong/1/68(H3N2). Meestal beperkt men zich tot de aanduiding type + subtype. In bovenstaand voorbeeld dus A/H3N2.[4-6]
Vermeerdering
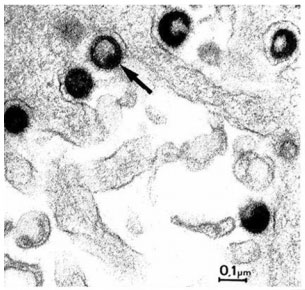
Virussen kunnen alleen in levende cellen vermeerderen. Influenzavirussen dringen het lichaam binnen door zich te hechten aan hemagglutinine eiwitten op het oppervlakte van epitheelcellen, in de neus, keel en longen bij zoogdieren, en in de darmen bij vogels. Door middel van endocytose zal de cel het virus opnemen.[7-9]
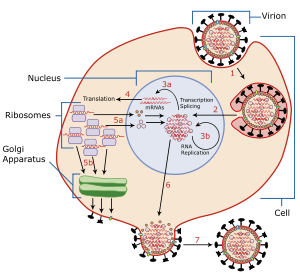 Door het zure milieu in de gastheercel vinden er vervolgens twee processen plaats. Als eerste zal een deel van het hemagglutinine eiwit de virusenvelop fuseren met het membraan van de vacuole. Daarna valt de kern uit elkaar en komt het virale RNA en komen de kerneiwitten vrij.[10, 11]
Door het zure milieu in de gastheercel vinden er vervolgens twee processen plaats. Als eerste zal een deel van het hemagglutinine eiwit de virusenvelop fuseren met het membraan van de vacuole. Daarna valt de kern uit elkaar en komt het virale RNA en komen de kerneiwitten vrij.[10, 11]
Deze kerneiwitten vormen een complex met het virale RNA dat de celkern in wordt getransporteerd. Door transcriptie wordt het RNA gekopieerd en wordt er messenger-RNA gevormd. Beide typen RNA verlaten de celkern weer. Het messenger-RNA zal op de ribosomen in het golgi-apparaat door middel van translatie zorgen voor de aanmaak van neuraminidase- en hemagglutinineiwitten, die hun weg richting het celmembraan zullen vinden, en nieuwe virusdeeltjes, die de celkern in gaan. Het gekopieerde RNA en de virusdeeltjes vormen een virion, die bij het verlaten van de cel een deel van het celmembraan van de gastheercel meeneemt. Op deze manier ontstaat een nieuwe virus.[12-14]
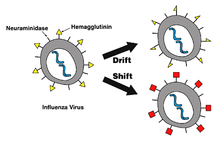 Door kleine foutjes tijdens het kopiëren van het viraal genoom ontstaan er langzaam wijzigingen in de antigenen op het virusmembraan. Dit proces wordt antigene drift genoemd. Een andere mogelijkheid is het samengaan van twee virusgenomen van verschillende typen influenzavirussen. Dit proces heet antigenen shift. Beide processen zijn de reden waarom vaccins kortdurend werken, meestal maar één seizoen. Daarna zijn de antigenen op het oppervlakte van de virussen zodanig veranderd, dat het immuunsysteem van het lichaam deze slecht of niet herkent.[15, 16]
Door kleine foutjes tijdens het kopiëren van het viraal genoom ontstaan er langzaam wijzigingen in de antigenen op het virusmembraan. Dit proces wordt antigene drift genoemd. Een andere mogelijkheid is het samengaan van twee virusgenomen van verschillende typen influenzavirussen. Dit proces heet antigenen shift. Beide processen zijn de reden waarom vaccins kortdurend werken, meestal maar één seizoen. Daarna zijn de antigenen op het oppervlakte van de virussen zodanig veranderd, dat het immuunsysteem van het lichaam deze slecht of niet herkent.[15, 16]
Vaccinatie in Nederland
 Op advies van de Gezondheidsraad worden in Nederland jaarlijks in de herfst risicogroepen en personeel uit de zorg uitgenodigd om een ‘griepprik’ bij de huisarts te komen halen. De risicogroepen bestaan uit mensen met een medische indicatie en mensen van 60 jaar en ouder. De griepprik bestaat uit een cocktail van griepvirussen die voor de komende periode wordt verwacht en maakt de gevaccineerde resistent tegen de meeste griepvirussen, maar is geen garantie om de griep niet te krijgen Wel vermindert het in dit laatste geval de symptomen.[17] In 2009 veroorzaakte het Nieuwe-Influenza-A-(H1N1)-virus een pandemie; de Mexicaanse griep. Op basis van een advies van de Gezondheidsraad en het RIVM werd besloten de bevolking te vaccineren.[18] Sinds 2010 wordt Mexicaanse griep beschouwd als een seizoensgriep.[2]
Op advies van de Gezondheidsraad worden in Nederland jaarlijks in de herfst risicogroepen en personeel uit de zorg uitgenodigd om een ‘griepprik’ bij de huisarts te komen halen. De risicogroepen bestaan uit mensen met een medische indicatie en mensen van 60 jaar en ouder. De griepprik bestaat uit een cocktail van griepvirussen die voor de komende periode wordt verwacht en maakt de gevaccineerde resistent tegen de meeste griepvirussen, maar is geen garantie om de griep niet te krijgen Wel vermindert het in dit laatste geval de symptomen.[17] In 2009 veroorzaakte het Nieuwe-Influenza-A-(H1N1)-virus een pandemie; de Mexicaanse griep. Op basis van een advies van de Gezondheidsraad en het RIVM werd besloten de bevolking te vaccineren.[18] Sinds 2010 wordt Mexicaanse griep beschouwd als een seizoensgriep.[2]
Vaccinproductie
Selectie van de virusstrengen
 De productie van een influenzavirusvaccin begint elk jaar in februari met het selecteren van de referentiestreng. 130 Nationale influenzacentra in 101 landen monitoren het hele jaar door veranderingen van influenzavirussen. Deze laboratoria zenden hun virussen naar de Wereldgezondheidsorganisatie (WHO) voor nadere analyse. De jaarlijkse griepprik is een trivalent vaccin waarvan elk component beschermd tegen de drie meest voorkomende groepen influenzavirussen in de mens; influenzavirus A (H1N1 en H3N2) en influenzavirus B. De drie vaccinvirussen die worden gekozen zijn virussen waarvan men verwacht dat zij het komende griepseizoen het meest zullen voorkomen. De WHO beveelt specifiek aan welke virussen gebruikt dienen te worden voor de productie van de vaccins, maar individuele landen kunnen hiervan afwijken. Producenten van influenzavirusvaccins kunnen deze referentiestrengen opvragen om te gebruiken in de productie van de vaccins.[19] In Nederland is voor het griepseizoen 2010/2011 gekozen voor het vaccin Influvac. Dit vaccin bevat oppervlakte-antigenen van de influenzavirus-strengen A/California/7/2009 (H1N1), A/Perth/16/2009 (H3N2) en B/Brisbane/60/2008, wat overeenkomt met de aanbeveling van de WHO.[20]
De productie van een influenzavirusvaccin begint elk jaar in februari met het selecteren van de referentiestreng. 130 Nationale influenzacentra in 101 landen monitoren het hele jaar door veranderingen van influenzavirussen. Deze laboratoria zenden hun virussen naar de Wereldgezondheidsorganisatie (WHO) voor nadere analyse. De jaarlijkse griepprik is een trivalent vaccin waarvan elk component beschermd tegen de drie meest voorkomende groepen influenzavirussen in de mens; influenzavirus A (H1N1 en H3N2) en influenzavirus B. De drie vaccinvirussen die worden gekozen zijn virussen waarvan men verwacht dat zij het komende griepseizoen het meest zullen voorkomen. De WHO beveelt specifiek aan welke virussen gebruikt dienen te worden voor de productie van de vaccins, maar individuele landen kunnen hiervan afwijken. Producenten van influenzavirusvaccins kunnen deze referentiestrengen opvragen om te gebruiken in de productie van de vaccins.[19] In Nederland is voor het griepseizoen 2010/2011 gekozen voor het vaccin Influvac. Dit vaccin bevat oppervlakte-antigenen van de influenzavirus-strengen A/California/7/2009 (H1N1), A/Perth/16/2009 (H3N2) en B/Brisbane/60/2008, wat overeenkomt met de aanbeveling van de WHO.[20]
Productieprocessen
Kort nadat de Wereldgezondheidsorganisatie de verwachte circulerende strengen aankondigt voor het komende seizoen, beginnen fabrikanten van vaccins met het maken van de nieuwe vaccinstrengen. Er bestaan twee typen influenzavirusvaccins: geïnactiveerde vaccins en live attenuated vaccins. Deze laatste wordt in de Verenigde Staten van Amerika toegediend via een neusspray. Geïnactiveerde vaccins, verantwoordelijk voor 90% van de wereldwijde vaccinproductie, kunnen worden ingedeeld in whole-virusvaccins en split- of subunitvaccins, zoals Influvac.
 De eerste stap van het produceren van een influenzavirusvaccins is viraal subtype reassortment, een techniek die al ruim 50 jaar bestaat en vrijwel universeel wordt gebruikt. Tijdens een proces, dat inoculatie wordt genoemd, worden de dooiers van bevruchte kippeneieren geïnjecteerd met een virus van de referentiestreng en met influenzastreng PR8 (H1N1 A/PR/8/34), die zo verzwakt is dat het apathogeen is en bovendien niet in staat om te repliceren in de mens. De eieren worden 2-3 dagen bij een bepaalde temperatuur en relatieve luchtvochtigheid geïncubeerd.
De eerste stap van het produceren van een influenzavirusvaccins is viraal subtype reassortment, een techniek die al ruim 50 jaar bestaat en vrijwel universeel wordt gebruikt. Tijdens een proces, dat inoculatie wordt genoemd, worden de dooiers van bevruchte kippeneieren geïnjecteerd met een virus van de referentiestreng en met influenzastreng PR8 (H1N1 A/PR/8/34), die zo verzwakt is dat het apathogeen is en bovendien niet in staat om te repliceren in de mens. De eieren worden 2-3 dagen bij een bepaalde temperatuur en relatieve luchtvochtigheid geïncubeerd.
 Tijdens dit proces vermeerderen de virussen zich en hun genen vermengen zich met elkaar tot 256 mogelijke combinaties van elk 8 genen. De allantoïsvloeistof uit de eieren met daarin de nieuwgevormde virussen wordt vervolgens geoogst. De beste kandidaat is het virus dat zo goed mogelijk groeit in eieren, maar tegelijk ook de gewenste HA en NA genen heeft van de referentiestreng. Dit wordt bepaald aan de hand van een HAI-titerbepaling (Haemagglutination Inhibition Test). De geselecteerde streng wordt wederom geïnoculeerd, geïncubeerd en geoogst. Concentratie en zuivering van het virus kan op twee verschillende manieren: door middel van hoge-snelheidcentrifuge op een sucrose-gradiënt, waarbij deeltjes gescheiden worden op basis van dichtheid, of in het geval van onder andere Influvac, door kolomchromatografie. Vervolgens worden de virussen geïnactiveerd met formaldehyde of β-propiolacton.
Tijdens dit proces vermeerderen de virussen zich en hun genen vermengen zich met elkaar tot 256 mogelijke combinaties van elk 8 genen. De allantoïsvloeistof uit de eieren met daarin de nieuwgevormde virussen wordt vervolgens geoogst. De beste kandidaat is het virus dat zo goed mogelijk groeit in eieren, maar tegelijk ook de gewenste HA en NA genen heeft van de referentiestreng. Dit wordt bepaald aan de hand van een HAI-titerbepaling (Haemagglutination Inhibition Test). De geselecteerde streng wordt wederom geïnoculeerd, geïncubeerd en geoogst. Concentratie en zuivering van het virus kan op twee verschillende manieren: door middel van hoge-snelheidcentrifuge op een sucrose-gradiënt, waarbij deeltjes gescheiden worden op basis van dichtheid, of in het geval van onder andere Influvac, door kolomchromatografie. Vervolgens worden de virussen geïnactiveerd met formaldehyde of β-propiolacton.
Subunitvaccins bevatten gezuiverde HA- en NA-oppervlakteantigenen met de overige virusdeeltjes verwijderd. Het splitsen van het virus gebeurt met een detergent zoals Triton X-100 of Triton N-101, dat het lipidenmembraan verstoort en dus de glycoproteïnen in het membraan oplosbaar maakt. Vervolgens wordt deze oplossing gefiltreerd om de HA- en NA-oppervlakteantigenen te verkrijgen. De verkregen vloeistof bevat aggregaten van monomere HA- en NA-oppervlakteantigenen en interne viruseiwitten zoals nucleoproteïnen, en heeft als voordeel dat het minder reactogeen is dan een whole-virusvaccin.
Alle bovenstaande processen gebeuren grotendeels geautomatiseerd en voor elke referentiestreng in aparte partijen (batches) en de drie referentiestrengen worden pas als laatste stap van het productieproces samengebracht en verdund, tot de gewenste vaccinsterkte is bereikt.[21-27]
Toekomst
 Een van de grootste nadelen van het gebruik van kippeneieren voor de productie van influenzavaccins is dat het een erg tijdrovend proces is. Vooral bij de ontdekking van een nieuw pandemische influenzavirus is tijd van groot belang om de bevolking tijdig voldoende te kunnen beschermen. Dit is een van de belangrijkste redenen dat er de laatste jaren steeds meer onderzoek is gedaan naar alternatieve manieren om influenzavaccins te produceren. Eén van de alternatieven en tevens de meest waarschijnlijke opvolger is het kweken van virussen op Madin-Darby Canine Kidney (MDCK) of Vero (African green monkey kidney) cell cultures. Solvay Diagnostics, de producent van Influvac, heeft onlangs een nieuwe fabriek geopend in Nederland en zal deze in de toekomst gaan gebruiken voor de grootschalige productie van influenzevaccins in cell cultures.[25, 28]
Een van de grootste nadelen van het gebruik van kippeneieren voor de productie van influenzavaccins is dat het een erg tijdrovend proces is. Vooral bij de ontdekking van een nieuw pandemische influenzavirus is tijd van groot belang om de bevolking tijdig voldoende te kunnen beschermen. Dit is een van de belangrijkste redenen dat er de laatste jaren steeds meer onderzoek is gedaan naar alternatieve manieren om influenzavaccins te produceren. Eén van de alternatieven en tevens de meest waarschijnlijke opvolger is het kweken van virussen op Madin-Darby Canine Kidney (MDCK) of Vero (African green monkey kidney) cell cultures. Solvay Diagnostics, de producent van Influvac, heeft onlangs een nieuwe fabriek geopend in Nederland en zal deze in de toekomst gaan gebruiken voor de grootschalige productie van influenzevaccins in cell cultures.[25, 28]
Referenties
- Eccles, R., Understanding the symptoms of the common cold and influenza. Lancet Infect Dis, 2005. 5(11): p. 718-25.
- Nieuws: Seizoensgriep 2010-2011 – 5 januari 2011 [cited 2011 2011-03-16]; Available from: http://www.rivm.nl/cib/actueel/nieuws/seizoensgriep-2010-2011.jsp.
- Hampson, A.W. and J.S. Mackenzie, The influenza viruses. Med J Aust, 2006. 185(10 Suppl): p. S39-43.
- Understanding the Dynamics of Influenza Vaccine Supply and Demand — Five Issue Briefs. 2011 [cited 2011 2011-05-16]; Available from: http://www.preventinfluenza.org/profs_production.asp.
- Lynch, J.P., 3rd and E.E. Walsh, Influenza: evolving strategies in treatment and prevention. Semin Respir Crit Care Med, 2007. 28(2): p. 144-58.
- Burgmeijer, H., Bolscher, Handboek Vaccinaties, infectieziekten en vaccinaties. 2007: Van Gorcum.
- Steinhauer, D.A., Role of hemagglutinin cleavage for the pathogenicity of influenza virus. Virology, 1999. 258(1): p. 1-20.
- Smith, A.E. and A. Helenius, How viruses enter animal cells. Science, 2004. 304(5668): p. 237-42.
- Wagner, R., M. Matrosovich, and H.D. Klenk, Functional balance between haemagglutinin and neuraminidase in influenza virus infections. Rev Med Virol, 2002. 12(3): p. 159-66.
- Bouvier, N.M. and P. Palese, The biology of influenza viruses. Vaccine, 2008. 26 Suppl 4: p. D49-53.
- Lakadamyali, M., et al., Visualizing infection of individual influenza viruses. Proc Natl Acad Sci U S A, 2003. 100(16): p. 9280-5.
- Cros, J.F. and P. Palese, Trafficking of viral genomic RNA into and out of the nucleus: influenza, Thogoto and Borna disease viruses. Virus Res, 2003. 95(1-2): p. 3-12.
- Kash, J.C., et al., Hijacking of the host-cell response and translational control during influenza virus infection. Virus Res, 2006. 119(1): p. 111-20.
- Nayak, D.P., E.K. Hui, and S. Barman, Assembly and budding of influenza virus. Virus Res, 2004. 106(2): p. 147-65.
- Drake, J.W., Rates of spontaneous mutation among RNA viruses. Proc Natl Acad Sci U S A, 1993. 90(9): p. 4171-5.
- Hilleman, M.R., Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. Vaccine, 2002. 20(25-26): p. 3068-87.
- NHG-Patiëntenbrief Griepprik. 2011 2011-03-15]; Available from: http://nhg.artsennet.nl/kenniscentrum/k_voorlichting/NHGPatientenbrieven/NHGPatientenbrief/PBR9b.htm.
- Vaccinatie Mexicaanse Griep. 2009 2011-03-15]; Available from: http://www.rijksoverheid.nl/onderwerpen/mexicaanse-griep/vaccinatie-mexicaanse-griep.
- Vaccine Selection for the 2010–2011 Influenza Season. 2011 [cited 2011 21-03-2011]; Available from: http://www.cdc.gov/flu/about/qa/1011_vac_selection.htm.
- Summary of Product Characteristics, Influvac 2010/2011. [PDF] 2011 [cited 2011 21-03-2011]; Available from: http://db.cbg-meb.nl/IB-teksten/h22289.pdf.
Bovenstaand artikel is geschreven door Ronnie Schuurbiers in het kader van de minor Disciplines Applied Science van de Fontys Hogescholen. Deze tekst mag in geen geval zonder uitdrukkelijke toestemming worden verspreid.
No Comments