Samenvatting
 In Nederland krijgen jaarlijks ruim 700 vrouwen baarmoederhalskanker, waarvan er 200 tot 250 vrouwen overlijden. Zonder screeningsprogramma zouden deze aantallen ten minste 2 keer zo hoog zijn. Baarmoederhalskanker wordt veroorzaakt door een infectie met een hoogrisico-type van het Humaan Papillomavirus (hrHPV). Overdracht van HPV heeft plaats tijdens seksueel contact. Meestal gaat de infectie vanzelf over en leidt deze niet tot cel- of weefselafwijkingen. Echter hoe langer hrHPV-infecties bestaan, des te groter de kans dat er veranderingen in de oppervlaktecellen ontstaan. Op den duur kan dit leiden een voorstadium van baarmoederhalskanker. Omdat het zo’n vijftien jaar duurt eer baarmoederhalskanker ontstaat, is de ziekte uitermate gezicht voor screening.
In Nederland krijgen jaarlijks ruim 700 vrouwen baarmoederhalskanker, waarvan er 200 tot 250 vrouwen overlijden. Zonder screeningsprogramma zouden deze aantallen ten minste 2 keer zo hoog zijn. Baarmoederhalskanker wordt veroorzaakt door een infectie met een hoogrisico-type van het Humaan Papillomavirus (hrHPV). Overdracht van HPV heeft plaats tijdens seksueel contact. Meestal gaat de infectie vanzelf over en leidt deze niet tot cel- of weefselafwijkingen. Echter hoe langer hrHPV-infecties bestaan, des te groter de kans dat er veranderingen in de oppervlaktecellen ontstaan. Op den duur kan dit leiden een voorstadium van baarmoederhalskanker. Omdat het zo’n vijftien jaar duurt eer baarmoederhalskanker ontstaat, is de ziekte uitermate gezicht voor screening.
Wanneer een voorstadium van baarmoederhalskanker wordt ontdekt, kan een behandeling voorkomen dat kanker ontstaat. Als er al sprake is van kanker, zorgt een vroege opsporing ervoor dat een effectieve behandeling in de meeste gevallen mogelijk is. In Nederland worden vrouwen tussen de 30 en 60 jaar eens per vijf jaar uitgenodigd voor het bevolkingsonderzoek. Zij laten bij de huisarts een uitstrijk maken, die in het laboratorium microscopisch wordt onderzocht. Bij licht afwijkende cellen krijgt de betrokken vrouw het advies op termijn een vervolguitstrijk te laten maken. Bij ernstige afwijkingen volgt direct verwijzing naar een gynaecoloog voor nader onderzoek en een eventuele behandeling.
Dit verslag bespreekt de rol van HPV in baarmoederhalskanker en de screening op baarmoederhalskanker in Nederland, en dient als onderlegger voor een informatieve folder, gericht op patiënten die uitgenodigd worden om een uitstrijkje te laten maken.
1. Baarmoederhalskanker en humaan pappilomavirus
De menselijke baarmoeder bestaat uit 2 onderdelen; corpus uteri of het lichaam van de baarmoeder (fig. 1, onderdeel 10), waar de embryo zich innestelt, en de cervix (soms cervix uteri) of baarmoederhals (fig. 1, onderdeel 12), die de verbinding tussen het lichaam van de baarmoeder en de vagina vormt.[2]
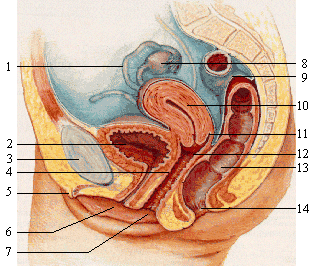 Figuur 1. De baarmoeder.[2]
Figuur 1. De baarmoeder.[2]
1.Eileider, 2.Blaas, 3.Schaambeen, 4.G-spot, 5.Clitoris, 6.Urinebuis, 7.Vagina, 8.Eierstok, 9.Dikke darm, 10.Baarmoeder, 11.Fornix uteri, 12.Baarmoederhals, 13.Endeldarm, 14.Anus
Baarmoederhalskanker of cervixcarcinoom is wereldwijd na borstkanker de meest voorkomende vorm van kanker bij vrouwen. Ongeveer 80% van de nieuwe gevallen van baarmoederhalskanker doen zich voor in ontwikkelingslanden. In Nederland wordt per jaar bij ruim 700 vrouwen baarmoederhalskanker gediagnosticeerd en jaarlijks overlijden tussen de 200 en 250 vrouwen aan deze aandoening. Onder meer dankzij het bevolkingsonderzoek zijn de ziektelast door en sterfte aan baarmoederhalskanker in Nederland lager dan in de ons omringende landen. Bovendien daalt in Nederland de incidentie (6,2 per 100.000 vrouwen per jaar) en sterfte door baarmoederhalskanker (2,0 per 100.000 vrouwen per jaar).[4]
Virussen veroorzaken ongeveer 15% van alle humane kankers en voor ongeveer de helft daarvan is het humaan papillomavirus (HPV) verantwoordelijk. In de jaren ’70 van de vorige eeuw werd het HPV voor het eerst aangetroffen bij baarmoederhalskanker, zodat het virus ervan werd verdacht een rol te spelen in deze ziekte. In diverse vervolgonderzoeken werd een zeer sterk verband gevonden tussen het optreden van baarmoederhalskanker en een infectie met HPV. Men gaat er tegenwoordig zelfs vanuit dat in alle gevallen van baarmoederhalskanker een HPV-infectie ten grondslag ligt, waarmee het een van de sterkst bekende verbanden tussen een omgevingsfactor en kanker bij de mens is.[5-9]
Er zijn meer dan 100 types bekend, waarvan meer dan 40 kunnen leiden tot genitale infecties, en tenminste 13 zijn kankerverwekkend bij mensen (HPV-types: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 en 66). Deze laatste groep zijn de hoogrisico types HPV (hrHPV). HPV-16 en -18 zijn samen verantwoordelijk voor respectievelijk 55 en 11% van alle gevallen van baarmoederhalskanker.[10,11]
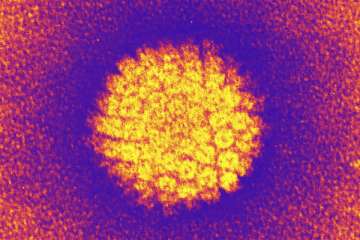
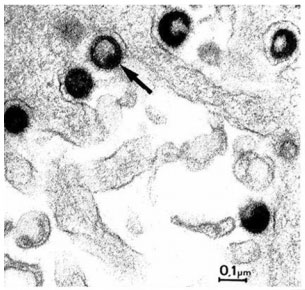
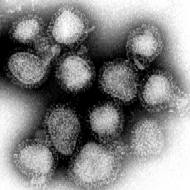
HPV is een Icosaëder (regelmatig twintigvlak) met een diameter van ongeveer 55nm. Het heeft circulair dubbelstrengs DNA van ongeveer 7900 baseparen. Het genoom codeert voor slechts negen eiwitten, verdeeld in twee groepen groepen: zeven Early (E) en twee Late (L). De Early-eiwitten komen tot expressie tijdens de replicatie van het virus, de differentiatie van de gastheercel en de migratie van de gastheercel naar de bovenste lagen van de opperhuid. Pas daarna komen de twee late eiwitten tot expressie.[10,11]
2. Pathogenese
Baarmoederhalskanker heeft als voorkeurslocatie het gebied tussen de endocervix (cilinderepitheel dat de binnenkant van het cervixkanaal bekleedt) en ectocervix (plaveiselepitheel dat de buitenkant van de cervix en de vaginawand bedekt), waarbij afwijkingen van het plaveiselepitheel het meeste voorkomen. Als voorstadia van cervixcarcinoom komen dysplastische afwijkingen voor, afwijkingen van de weefselstructuur van de baarmoederhals. Deze afwijkingen worden cervicale intra-epitheliale neoplasie (CIN-laesies) genoemd. CIN1-, CIN2- en CIN3-laesies geven aan dat het om respectievelijk een geringe, matige of ernstige dysplasie gaat. Deze voorloperlaesies kunnen in verschillende volgorde verschijnen.[12]
De meerderheid van de vrouwen raakt gedurende hun leven geïnfecteerd met hrHPV. HPV-infecties zijn zeer besmettelijk. Direct huid op huid en slijmvlies op slijmvlies contact, gepaard gaande met microlaesies, zorgt voor verspreiding. 60 tot 80% van de jonge vrouwen die seksueel actief worden, loopt binnen vijf jaar een infectie op met een of meerdere hrHPV-types. HPV-infectie hoort dan ook bij de groep seksueel overdraagbare aandoeningen (SOA’s). De incubatietijd tussen HPV-infectie en het optreden van baarmoederhalskanker duurt in de meeste gevallen ten minste vijftien jaar. Van HPV besmetting naar CIN2/3 duurt 2,5 tot 4 jaar; van CIN3 tot cervixcarcinoom 10 tot 15 jaar. Bij de meeste vrouwen wordt de infectie binnen acht tot veertien maanden vanzelf geklaard door het immuunsysteem. Bij 10 tot 20% ontstaat een blijvende HPV-infectie. Deze persisterende infectie kan leiden tot premaligne afwijkingen. Toch genezen deze persisterende HPV-infecties en zelfs CIN-laesies vaker wel dan niet spontaan.[12,13]
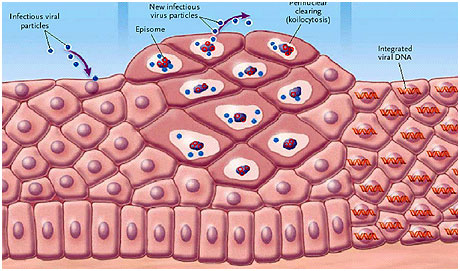 Figuur 2. HPV-infectie. Links gezond baarmoederhalsweefsel, in het midden de fase waarin het virus zich verspreidt, rechts de integratie van het virus in het DNA van de cellen, wat uiteindelijk kan leiden tot baarmoederhalskanker.[3]
Figuur 2. HPV-infectie. Links gezond baarmoederhalsweefsel, in het midden de fase waarin het virus zich verspreidt, rechts de integratie van het virus in het DNA van de cellen, wat uiteindelijk kan leiden tot baarmoederhalskanker.[3]
Infectie met HPV veroorzaakt bij slechts een klein deel van de geïnfecteerde vrouwen uiteindelijk baarmoederhalskanker. Cofactoren, zoals roken, het aantal seksuele partners en gebruik van orale anticonceptiva, spelen in vergelijking met HPV een geringe rol bij het ontstaan van cervixcarcinoom. Het gebruik van orale anticonceptiva leidt tot een geringe toename in de incidentie van cervixcarcinoom, maar er zijn geen redenen om vrouwen daarom het gebruik daarvan te ontraden. Consequent condoomgebruik vermindert de incidentie van HPV-gerelateerde afwijkingen. Pappilomavirussen veroorzaken ook wratten; goedaardige, zelf-afnemende laesies van de huid, mondholte en anogenitale tract. Een verband met baarmoederhalskanker is niet aangetoond.
[11,12,14-16]
3. Screening
3.1 Organisatie van de landelijke screening
In Nederland wordt sinds 2008 landelijk gescreend op cervixcarcinoom. Vrouwen tussen de 30 en 60 jaar krijgen eens in de 5 jaar een uitnodiging voor het bevolkingsonderzoek baarmoederhalskanker. Afhankelijk van het gebied waar men woont wordt de uitnodiging verzorgd door de huisarts, een screeningsorganisatie of de GGD. Het doel van dit bevolkingsonderzoek is de vroege opsporing van (voorstadia van) cervixcarcinoom: secundaire preventie. Door eenmaal per vijf jaar een uitstrijk te maken kunnen de meeste gevallen van (voorstadia van) cervixcarcinoom vroegtijdig opgespoord kunnen worden. De voorstadia kunnen effectief worden behandeld, waardoor het ontstaan van cervixcarcinoom kan worden voorkomen.
Redenen zijn om van de screening af te zien zijn:
- Er is een uterusextirpatie verricht, waarbij de cervix is verwijderd;
- De vrouw is nog onder gynaecologische controle wegens cervixpathologie; de vrouw wordt in dit geval verzocht de uitnodigingskaart mee te nemen naar de gynaecoloog;
- De vrouw is korter dan zes maanden tevoren ontslagen uit een behandeling wegens cervixcarcinoom of een voorstadium daarvan;
- Er is minder dan een jaar geleden een uitstrijk op indicatie gemaakt.
Redenen om het maken van de uitstrijk uit te stellen zijn:
- Zwangerschap of de eerste zes maanden na de bevalling;
- Menstrueel bloedverlies of een onttrekkingsbloeding.
In plaats van het klassieke uitstrijkje (Cytobrush en Cervexbrush), waarbij het celmateriaal op een objectglas wordt uitgestreken, wordt in toenemende mate gebruikt gemaakt van dunnelaagcytologie. Een dergelijke uitstrijk is minder tijdrovend dan de conventionele techniek en mogelijk hoeven minder uitstrijken afgekeurd te worden wegens onbeoordeelbaarheid. Dunnelaagcytologie biedt tevens de mogelijkheid tot HPV-diagnostiek: de HPV-test kan worden uitgevoerd op de cellen in de suspensie.[12,17]
3.2 Het maken van een uitstrijkje
De huisarts, assistent of gynaecoloog stelt het speculum zodanig in dat een goede macroscopische beoordeling van de cervix mogelijk is. Bij macroscopisch verdachte afwijkingen zoals een proliferatief onregelmatig oppervlak of ulceratie van de portio (verzwering van de baarmoedermond) wordt de patiënt doorverwezen en wordt de uitstrijk achterwege gelaten. Als er geen macroscopisch verdachte afwijkingen zijn, wordt de uitstrijk volgens een van de volgende methoden uitgevoerd.
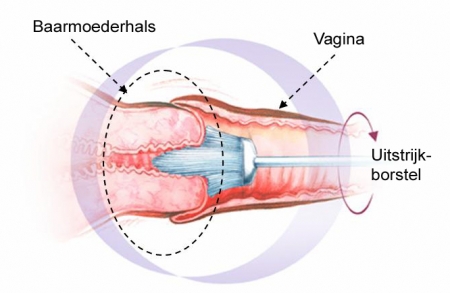 Figuur 3. Het uitstrijkje. De borstel wordt 360º in het endocervicale kanaal rondgedraaid om het celmateriaal te verkrijgen. [1]
Figuur 3. Het uitstrijkje. De borstel wordt 360º in het endocervicale kanaal rondgedraaid om het celmateriaal te verkrijgen. [1]
- De Cytobrush wordt bij voorkeur in combinatie met de houten spatel gebruikt. Het borsteltje wordt 360º in het endocervicale kanaal rondgedraaid. Het celmateriaal wordt vervolgens op één helft van het objectglas gebracht en daarna gefixeerd, terwijl de andere helft van het objectglas wordt afgedekt. De spitse punt van een houten spatel wordt vervolgens onder constante lichte druk ten minste 360º rondgedraaid in de cervixmond. Bij een ruim ectropion (cilindrisch epitheel in de schede) wordt ook de buitenrand van de ectocervix (het deel van de cervix dat in de vagina zichtbaar is) uitgestreken met het brede uiteinde van de spatel. Het celmateriaal wordt op de andere helft (van dezelfde zijde) van het objectglas aangebracht. Ten slotte wordt het geheel gefixeerd.
- De Cervexbrush wordt vijfmaal 360º rondgedraaid in de cervixmond. Het celmateriaal wordt vervolgens gelijkmatig en niet te dik over het objectglaasje uitgestreken en daarna gefixeerd.
- Bij dunnelaagcytologie wordt celmateriaal via de Cervexbrush overgebracht in een potje met bewaarvloeistof door het borsteltje van de Cervexbrush van het steeltje te drukken of, afhankelijk van het laboratorium, door het borsteltje juist niet af te breken maar een 10-tal keer uit te duwen tegen de bodem van het potje. In het laatste geval mag het potje géén brush uiteinde bevatten. Meestal is het type brush of onbreekbaar of juist geperforeerd afhankelijk van de gebruikte dunnelaagtechniek.
Het gebruik van een HPV-thuistest (self-sampling) voor vrouwen die niet reageren op een oproep voor de screening wordt op dit moment onderzocht. Het nadeel van de thuistest is dat er alleen kan worden gekeken of er hr-HPV aanwezig is en niet of er relevante afwijkende cellen zijn. Als er hr-HPV wordt gevonden, moet er daarom alsnog een uitstrijkje gemaakt worden. [12,18]
3.3 Laboratoriumonderzoek
Screenen gebeurt van oudsher door morfologisch abnormale cellen op te sporen in een uitstrijkpreparaat van cellen van de baarmoedermond; de Pap-test. Deze methode wordt steeds meer vervangen door dunnelaagcytologie. Dunnelaagcytologie is een nieuwe techniek om het uitstrijkpreparaat te fixeren. Hierbij wordt in het laboratorium het celmateriaal als dunne cellaag op een objectglas gebracht en microscopisch onderzocht. Voordelen zijn een meer representatief monster (door de meer losliggende cellen), een betere fixatie van de cellen, een betere verdeling van de cellen over het glaasje en de mogelijkheid het overgebleven materiaal te gebruiken voor aanvullend onderzoek. Over de diagnostische waarde van dunnelaagcytologie vergeleken met conventionele technieken is discussie. In een meta-analyse wordt geconcludeerd dat dunnelaagcytologie noch sensitiever, noch specifieker is dan de conventionele Pap-test.[12,17,19]
Bij HPV-testen wordt celmateriaal met een DNA-test specifiek onderzocht op de aanwezigheid van genetisch materiaal van hrHPV. De HPV-test heeft een grotere sensitiviteit dan de conventionele uitstrijk voor CIN2/3 en baarmoederhalskanker, maar een iets lagere specificiteit. Uit een Zwitsers onderzoek blijkt bovendien dat toevoeging van de HPV-test aan de Pap-test om vrouwen te screenen op cervixcarcinoom de incidentie van CIN2/3-laesies en kanker vermindert.[12,17,20]
3.4 Beoordeling van de uitslag
De uitslag van het onderzoek wordt via een brief bekend gemaakt. Als verwijzing naar de gyneacoloog nodig is, neemt uw huisarts eerst contact op. Er zijn verschillende uitslagen mogelijk.[21]
- PAP 1, geen afwijkingen: Er zijn geen aanwijzingen voor baarmoederhalskanker of een voorstadium daarvan in het uitstrijkje gevonden (95% van de vrouwen).
- PAP 0, niet goed te beoordelen: Het uitstrijkje was niet goed te beoordelen, bijvoorbeeld doordat er te weinig cellen waren of doordat er te veel bloed in het uitstrijkje zat (2% van de vrouwen). Men krijgt het advies om over 6 weken opnieuw een uitstrijkje laten maken.
- PAP 2 of 3a1, lichte afwijking: Er zijn afwijkende cellen gevonden, maar deze cellen zijn geen baarmoederhalskanker (2 – 3% van de vrouwen). Vaak verdwijnen de afwijkende cellen vanzelf. Men krijgt het advies om na 6 en 12 maanden opnieuw een vervolguitstrijkje te laten maken.
- PAP 3a2, PAP 3b, PAP 4 en PAP 5, ernstige afwijking: Er zijn ernstige afwijkingen gevonden (1% van de vrouwen). Van elke 30 vrouwen met deze uitslag heeft ongeveer 1 vrouw kanker. De andere vrouwen hebben een voorstadium daarvan. Men wordt doorverwezen naar de gynaecoloog voor nader onderzoek. Het voorstadium wordt meestal behandeld om te voorkomen dat baarmoederhalskanker kan ontstaan.
Soms worden ook KOPAC-codes gebruikt om de uitslag weer te geven. De onderstaande tabel, afkomstig van de website van het RIVM, geeft een overzicht van de PAP- en KOPAC-codes, en de betekenis daarvan.
 Tabel 1. Uitslagen van het onderzoek en vervolgonderzoek.[22]
Tabel 1. Uitslagen van het onderzoek en vervolgonderzoek.[22]
3.5 Wat gaat er veranderen in de screening?
De Gezondheidsraad heeft op 24 mei 2011 aan de minister van Volksgezondheid Welzijn en Sport een advies gegeven over mogelijkheden om het bevolkingsonderzoek baarmoederhalskanker te verbeteren. Een grote groep 30-jarigen en allochtone vrouwen doet niet mee met het bevolkingsonderzoek. De grootste afwijkingen en de meeste gevallen van baarmoederhalskanker worden gevonden bij vrouwen die niet of onregelmatig meedoen aan het bevolkingsonderzoek. Er is een nieuwe test ontwikkeld die mogelijk beter is dan de bestaande test.[18]
De Gezondheidsraad adviseerde de volgende aanpassingen om het bevolkingsonderzoek te verbeteren:
- Bij de beoordeling van het uitstrijkje wordt eerst de nieuwe hr-HPV-test gebruikt, omdat deze gevoeliger is dan de bestaande test. Er wordt in eerste instantie dus alleen gekeken naar de aanwezigheid van hr-HPV-typen.
- Als er hr-HPV gevonden is wordt het uitstrijkje nog een keer beoordeeld. Ditmaal wordt wel gekeken of er ook relevante afwijkende cellen aanwezig zijn.
- Vrouwen worden minder vaak uitgenodigd voor het bevolkingsonderzoek baarmoederhalskanker. De nieuwe hr-HPV-test geeft langer zekerheid dat de kans op afwijkingen erg klein is.
- Er wordt geprobeerd de deelname aan het bevolkingsonderzoek te vergroten. Bijvoorbeeld door meer vrouwen uit te nodigen met een afspraak op datum en tijd en door een thuistest op te sturen naar vrouwen die niet reageren op de uitnodiging voor het bevolkingsonderzoek.
Referenties
- Wat is een uitstrijkje? in Baarmoederhalskankeronline (2012).
- Wikipedia-bijdragers. Baarmoeder. in Wikipedia, de vrije encyclopedie (2012).
- Kees Melief wint Prijs van Wetenschap & Maatschappij. in Universiteit Leiden/HP (2006).
- Janssen, D.P.G.H. Bevolkingsonderzoek naar cervixcarcinoom. Bijblijven 25, 24-33 (2009).
- Parkin, D.M. & Bray, F. Chapter 2: The burden of HPV-related cancers. Vaccine 24 Suppl 3, S3/11-25 (2006).
- zur Hausen, H., Meinhof, W., Scheiber, W. & Bornkamm, G.W. Attempts to detect virus-secific DNA in human tumors. I. Nucleic acid hybridizations with complementary RNA of human wart virus. Int J Cancer 13, 650-6 (1974).
- zur Hausen, H. Human papillomaviruses and their possible role in squamous cell carcinomas. Curr Top Microbiol Immunol 78, 1-30 (1977).
- Bosch, F.X. et al. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. International biological study on cervical cancer (IBSCC) Study Group. J Natl Cancer Inst 87, 796-802 (1995).
- Walboomers, J.M. et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 189, 12-9 (1999).
- Clifford, G., Franceschi, S., Diaz, M., Munoz, N. & Villa, L.L. Chapter 3: HPV type-distribution in women with and without cervical neoplastic diseases. Vaccine 24 Suppl 3, S3/26-34 (2006).
- Smith, J.S. et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: a meta-analysis update. Int J Cancer 121, 621-32 (2007).
- Boomsma LJ, B.P., Collette C, Janssen PGH. NHG-Standaard Preventie en vroegdiagnostiek van cervixcarcinoom (Tweede herziening). Huisarts Wet (2009).
- Carter, J.J. et al. The natural history of human papillomavirus type 16 capsid antibodies among a cohort of university women. J Infect Dis 174, 927-36 (1996).
- Schmeink, C.E., Lenselink, C.H. & Bekkers, R.L. [Use of oral contraceptives and increased risk of cervical cancer]. Ned Tijdschr Geneeskd 152, 1717-8 (2008).
- Appleby, P. et al. Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet 370, 1609-21 (2007).
- Rieck, G. & Fiander, A. The effect of lifestyle factors on gynaecological cancer. Best Pract Res Clin Obstet Gynaecol 20, 227-51 (2006).
- Netherlands, H.C.o.t. Population screening for cervical cancer. (2011).
- RIVM. Bevolkingsonderzoek baarmoederhalskanker, advies Gezondsheidsraad.
- Arbyn, M. et al. Liquid compared with conventional cervical cytology: a systematic review and meta-analysis. Obstet Gynecol 111, 167-77 (2008).
- Naucler, P. et al. Human papillomavirus and Papanicolaou tests to screen for cervical cancer. N Engl J Med 357, 1589-97 (2007).
- RIVM. Bevolkingsonderzoek baarmoederhalskanker, de uitslag van het uitstrijkje. (2012).
- RIVM. Bevolkingsonderzoek baarmoederhalskanker, uitslagen van het onderzoek en vervolgonderzoek. (2012).
Bovenstaand artikel is geschreven door Ronnie Schuurbiers in het kader van de minor Disciplines Applied Science van de Fontys Hogescholen. Deze tekst mag in geen geval zonder uitdrukkelijke toestemming worden verspreid.

No Comments