Samenvatting
 Volledige of gedeeltelijke kleurenblindheid is het niet volledig of niet normaal waarnemen van kleuren en kan zowel congenitaal (aangeboren) als verworven zijn. Congenitale kleurenblindheid komt verreweg het meeste voor, in de Amerikaanse bevolking bij ongeveer 8% van alle mannen en 0,5% van alle vrouwen. Kleurenblindheid kan hinderlijk zijn en problemen geven in het dagelijks leven, bijvoorbeeld bij het uitoefenen van een beroep. De wens om kleurenblindheid te genezen is aanwezig en gentherapie is in ieder geval in theorie een goede kandidaat als behandeling voor congenitale kleurenblindheid. Er zijn diverse onderzoeken uitgevoerd met dierenmodellen die laten zien dat de techniek aanwezig is om een klinische trial met mensen te starten. Cruciale vragen op het gebied van veiligheid, effectiviteit en ethiek blijken echter nog onvoldoende beantwoord, zodat een toepassing van gentherapie voor de behandeling van congenitale kleurenblindheid niet in de nabije toekomst mag worden verwacht.
Volledige of gedeeltelijke kleurenblindheid is het niet volledig of niet normaal waarnemen van kleuren en kan zowel congenitaal (aangeboren) als verworven zijn. Congenitale kleurenblindheid komt verreweg het meeste voor, in de Amerikaanse bevolking bij ongeveer 8% van alle mannen en 0,5% van alle vrouwen. Kleurenblindheid kan hinderlijk zijn en problemen geven in het dagelijks leven, bijvoorbeeld bij het uitoefenen van een beroep. De wens om kleurenblindheid te genezen is aanwezig en gentherapie is in ieder geval in theorie een goede kandidaat als behandeling voor congenitale kleurenblindheid. Er zijn diverse onderzoeken uitgevoerd met dierenmodellen die laten zien dat de techniek aanwezig is om een klinische trial met mensen te starten. Cruciale vragen op het gebied van veiligheid, effectiviteit en ethiek blijken echter nog onvoldoende beantwoord, zodat een toepassing van gentherapie voor de behandeling van congenitale kleurenblindheid niet in de nabije toekomst mag worden verwacht.
Inleiding
Het menselijk oog is in staat om licht van drie verschillende golflengtes te kunnen waarnemen, in het spectrum van paars tot rood. Kleurenblindheid is het onvermogen om kleuren op de gebruikelijke manier te zien. Eén of meerdere golflengtes kunnen afwezig of verschoven zijn en dus worden de corresponderende kleuren niet of anders weergegeven. Dit leidt in de praktijk soms tot vervelende situaties, bijvoorbeeld tijdens het uitoefenen van een beroep. Vrijwel alle vormen van kleurenblindheid zijn congenitaal en het gevolg van defecte genen. In theorie is gentherapie dus een kandidaat voor de behandeling van congenitale kleurenblindheid. Gentherapie is een veelbelovende, relatief nieuwe techniek die al enkele jaren in ontwikkeling is. Dit artikel legt uit wat kleurenblindheid en gentherapie is en onderzoekt de mogelijkheid van het inzetten van gentherapie voor de behandeling van kleurenblindheid bij mensen.
1. Kleurenblindheid
1.1 Celbiologie van het oog
De retina of het netvlies is een sterk doorbloed, lichtgevoelig gebied achter in het menselijk oog. Het bestaat uit ongeveer 126 miljoen lichtgevoelige zintuigcellen die onder te verdelen zijn in kegeltjes en staafjes. De staafjes werken vooral bij weinig licht en stellen het lichaam instaat het verschil tussen licht en donker waar te nemen. De kegeltjes zijn vooral actief bij daglicht en maken het mogelijk kleuren te onderscheiden. Normaal menselijk kleurenzicht is trichromatisch, wat betekent dat elke kleur wordt gevormd door een mengsel van drie basiskleuren. Er bestaan dan ook drie verschillende soorten kegeltjes, elk het meest gevoelig in een ander golflengtegebied van het lichtspectrum: S-, M- en L-kegeltjes (uit het Engels: short, medium en large wavelengths), ook wel blauw-, groen- en rood-kegeltjes genoemd (figuur 1). Het menselijk oog is daarmee in staat licht waar te nemen in het gebied tussen 380 tot 740 nm. De kegeltjes bevatten fotopigmenten, lichtgevoelige eiwitten, die worden geactiveerd zodra zij licht absorberen. Op die manier wordt een signaalcascade in gang gezet naar zenuwcellen in de hersenen. De fotopigmenten bestaan uit twee componenten. Het eerste deel is een foto-opsine; het tweede deel is retinaldehyde, een derivaat van vitamine A.[6, 7]
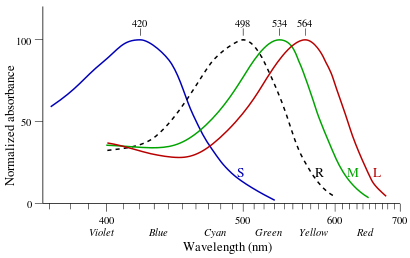
Figuur 1. Lichtabsorptie van de pigmenten in staafjes (onderbroken lijn) en de drie soorten kegeltjes (L, M en S). [4]
1.2 Genetische basis voor het zien van kleuren
De genen die coderen voor de rode en groene fotopigmenten (OPN1LW en OPN1MW) kennen 96% aminozuursequentie overlap met elkaar, maar slechts 46% aminozuursequentie overlap met het gen dat codeert voor het blauwe fotopigment (OPN1SW). De rode en groene fotopigmentgenen bevinden zich op het X-chromosoom; het blauwe fotopigmentgen bevindt zich op chromosoom 7. OPN1LW en OPN1MW komen in de normale populatie altijd in een tandemarray voor, waarbij OPN1LW één keer voorkomt, direct gevolgd door één tot en met vijf nagenoeg identieke genen voor OPN1MW (figuur 2). Naast het OPN1LW gen komt alleen het eerste OPN1MW gen voldoende tot expressie om van invloed te zijn op het kunnen onderscheiden van kleuren, zodat het fenotype hetzelfde blijft ongeacht het aantal groene fotopigmentgenen. Een ander belangrijk gebied voor de rode en groene fotopigmentgenen is de locus control region (LCR) die zich voor de tandemarray bevindt.[8] De functie van de LCR is het reguleren van de genexpressie (vergelijkbaar met die van promotorregio’s). Polymorfismen in de fotopigmentgenen komen veelvuldig voor, maar leiden niet altijd tot merkbare veranderingen in het zien van kleuren. Recombinantie van de fotopigmentgenen leidt bij ongeveer 10% van de bevolking tot een (ernstige) vorm van kleurenblindheid.[5, 7]
1.3 Verschillende typen congenitale kleurenblindheid
Kleurenblindheid wordt doorgaans geclassificeerd op basis van hevigheid van het klinische fenotype. De typen worden verder onderscheiden op basis van type kegeltjes die hierbij betrokken zijn.[5]
Monochromatopsie is de meest ernstige vorm van kleurenblindheid. Monochromatopsie is het onvermogen om kleuren te kunnen onderscheiden. Er is sprake van monochromatopsie wanneer twee van de drie soorten kegeltjes defect zijn of ontbreken. Personen met monochromatopsie zien de wereld in één kleurentint. Monochromatopsie wordt verder onderverdeeld in rode, groene of blauwe kegel monochromatopsie (waarbij de respectievelijk de rode, groenen en blauwe kegeltjes zijn aangedaan), en staaf monochromatopsie en incomplete achromatopsie (waarbij alle drie de kegeltjes zijn aangedaan).
Dichromatopsie is een minder erge vorm van kleurenblindheid dan monochromatopsie. Eén van de drie soorten kegeltjes zijn defect of ontbreken. Personen met dichromatopsie zijn niet in staat om bepaalde kleuren van elkaar te onderscheiden. Dichromatopsie wordt verder onderverdeeld in protanopie, deuteranopie en tritanopie, waarbij de respectievelijk de rode, groene en blauwe kegeltjes zijn aangedaan.
Anomale trichromatopsie is de mildste vorm van kleurenblindheid. Net als personen met een normaal kleurenzicht gebruiken personen met anomale trichromatopsie de drie primaire kleuren om de andere kleuren te kunnen zien, maar de manier waarop zij dit doen is afwijkend. Eén van de fotopigmenten heeft namelijk een verschoven optimale gevoeligheid voor de betreffende kleur. Anomale trichromatopsie wordt verder onderverdeeld in protanomalie, deuteranomalie en tritanomalie, waarbij de respectievelijk de rode, groenen en blauwe kegeltjes zijn aangedaan.
Wanneer kleurenblindheid wordt geclassificeerd op basis van uitingsvorm kan onderscheid worden gemaakt tussen volledige en gedeeltelijke kleurenblindheid. Gedeeltelijke kleurenblindheid kan zich uiten als rood-groen kleurenblindheid en geel-blauw kleurenblindheid. Rood-groen kleurenblindheid wordt veroorzaakt door dichromatopsie (varianten protanopie en deuteranopie) of anomale trichromatopsie (varianten protanomalie en deuteranomalie). Geel-blauw kleurenblindheid wordt veroorzaakt door dichromatopsie (variant tritanopie).
1.4 De genetische basis van congenitale kleurenblindheid
Volledige of gedeeltelijke kleurenblindheid is het niet volledig of niet normaal waarnemen van kleuren. De oorzaak van dit probleem kan congenitaal of verworven zijn. Congenitale kleurenblindheid is meestal een geslachtsgebonden ziekte. Twee van de drie genen die verantwoordelijk zijn voor de pigmentmoleculen binden zich op het X-chromosoom. Congenitale kleurenblindheid komt om die reden veel vaker voor bij mannen, die slechts één X-chromosoom hebben, dan bij vrouwen. Congenitale kleurenblindheid is een van de meest voorkomende vormen van erfelijke ziektes van het oog, waarbij 8% van alle mannen en 0,5% van alle vrouwen zijn aangedaan.[1, 5, 7]
Rood-groen kleurenblindheid
Vormen van rood-groen kleurenblindheid zijn allen x-gebonden recessieve ziektes, veroorzaakt door mutaties in de genen die coderen voor rode en groene fotopigmenten of de LCR. Bij personen zonder een LCR komen de rode en groene fotopigmentgenen in zijn geheel niet tot expressie. Door de grote aminozuursequentie overlap tussen de rode en groene fotopigmentgenen en doordat zij als tandem array voorkomen komen er veel ongelijke recombinaties voor. Dit heeft als gevolgd dat genen compleet verdwijnen of dat er zogehete rood-groene hybride genen ontstaan (figuur 2). Puntmutaties in de rode en groene fotopigmentgenen en de LCR zijn zeldzamer, maar zijn beschreven. Ook zijn er deleties ontdekt in het rode fotopigmentgen.[5, 7]
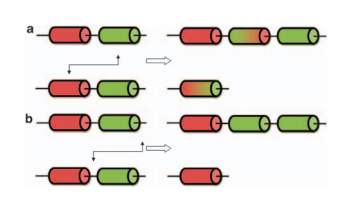
Figuur 2. Schematische diagram van recombinaties in de x-gebondenfotopigmentgenen. Normale rood-groene fotopigmentgenen bevinden zich in een tandam array. Door ongelijke recombinatie van deze fotopigmentgenen kunnen hybride genen ontstaan (a) of fotopigmentgenen kunnen worden gedupliceerd of volledig verdwijnen (b).[5]
Tritan deficiënties
Kleurenblindheid waarbij de blauwe fotopigmentgenen zijn aangedaan stond voorheen bekend als blauw-gele kleurenblindheid, maar tegenwoordig gebruikt men de term tritan deficiënties. Deze vormen van kleurenblindheid komen veel minder vaak voor dan rood-groene kleurenblindheid, ongeveer 1 op de 500 personen is aangedaan. Het zijn erfelijke autosomale dominante ziektes, die het resultaat zijn van missense mutaties in het blauwe fotopigmentgen.[5, 7]
Monochromatopsie
Blauwe kegel monochromatopsie is een erfelijke x-gebonden recessieve ziekte, die het resultaat is van drie categorieën mutaties. In de eerste categorie komen de mutaties voor in de LCR. In de tweede categorie leidt ongelijke recombinatie tot een puntmutatie in of deletie van het blauwe fotopigmentgen, zodat de gecodeerde eiwitten niet functioneel zijn. In de derde en laatste categorie komt voor bij personen met twee blauwe fotopigmentgenen, die beide mutaties hebben die coderen voor niet-functionele eiwitten.[5, 7]
Achromatopsie
Achromatopsie of kegeltjesdsystrofie is het onvermogen om kleuren te kunnen zien. Beiden zijn autosomale recessieve ziektes. Bij autosomale ziektes liggen de betreffende genen niet op de geslachtschromosomen, maar op één van de andere chromosomen. Bij achromatopsie type 2 en 3 werken de kegeltjes in zijn geheel niet. Bij kegel-staafdystrofie, een andere (onvolledige) vorm van achromatopsie, gaan de kegeltjes gedurende het leven verloren. Personen met achromatopsie zien de wereld in zwart, wit en grijstinten. De oorzaak van congenitale achromatopsie ligt aan defecten in de genen CNGA3, CNGB3, GNAT2. Deze genen zijn van invloed op bepaalde ionkanalen in de kegeltjes. Deze ionkanalen zijn een cruciaal onderdeel van de signaalcascade, een mechanisme in de kegeltjes dat er voor zorgt dat de energie van fotonen wordt omgezet in zenuwimpulsen.[5, 7]
2. Gentherapie
Hoewel een persoon met een milde vorm van kleurenblindheid dit soms niet eens opmerkt, kunnen personen met ernstigere vormen van kleurenblindheid problemen ondervinden met het functioneren in het dagelijks leven. Zo kunnen zij bijvoorbeeld moeite hebben met het lezen van kaarten en plattegronden, en kunnen zij niet herkennen wanneer sommige soorten fruit rijp zijn. Ook kunnen personen met kleurenblindheid bepaalde beroepen niet of minder goed uitvoeren. Voorbeelden hiervan zijn elektricien (kleurencodering van draden), kok (gaar vlees heeft een andere kleur dan rauw vlees) en docent scheikunde (kleurreacties). Ook mogen piloten met bepaalde vormen van kleurenblindheid alleen overdag vliegen. De wens om kleurenblindheid te behandelen of zelfs genezen is dus aanwezig. Op dit moment bestaat er echter nog geen behandeling van deze aandoening. Wel kunnen speciale brillen en contactlenzen als hulpmiddel worden gebruikt om kleuren beter te kunnen onderscheiden. Omdat kleurenblindheid in de meeste gevallen congenitaal is, lijkt het voor de hand te liggen de aandoening te behandelen door een verandering aan te brengen in de genen. Gentherapie is daarom een potentiële kandidaat om deze aandoening te behandelen of genezen.
2.1 Gentherapie
Gentherapie is het introduceren, wijzigen of verwijderen van genen in een cel, met als doel het behandelen van een ziekte. Het is een relatief nieuwe, veelbelovende techniek die op dit moment alleen nog experimenteel wordt toegepast.[9] De ontwikkeling van belangrijke technieken, zoals het gebruik van virussen om cellen van zoogdieren te kunnen veranderen in de jaren ’60 en recombinant DNA in de jaren ’70, en de toenemende kennis op het gebied van de functie van menselijke genen, legden in de jaren ‘70 de basis voor het concept van gentherapie.[10, 11]
De meest voorkomende vorm van gentherapie voor de behandeling van erfelijke aandoeningen bestaat uit het invoegen van een functioneel gen in het genoom van de patiënt. Veel erfelijke aandoeningen ontstaan door een defect of ontbrekend gen in bepaalde cellen, zodat er niet-functionele of zelfs helemaal geen eiwitten worden gecodeerd. Een voorbeeld hiervan is congenitale achromatopsie (zie eerder). Door in de betreffende cellen een functionerend gen tot expressie te brengen, zal deze coderen voor het voorheen niet-functionerende of ontbrekende eiwit. Om het betreffende gen af te leveren in de juiste cellen worden vectoren gebruikt. De meest gebruikte manieren om dit te doen zijn het injecteren van DNA of het gebruik van virussen. De keuze voor virussen als vector ligt voor de hand; virussen hebben immers miljoenen jaren evolutie ondergaan en bezitten systemen om cellen van de gastheer eenvoudig binnen te dringen en daar hun DNA te integreren in het genoom. Vooral adenovirussen zijn goede kandidaten om het te introduceren gen naar de juiste gastheercellen te vervoeren (figuur 3), omdat zij instaat zijn vrijwel elk celtype te infecteren. Daarbij zijn adenovirussen zeer goed instaat om de gastheercel aan te zetten tot het coderen van virale eiwitten.[9, 11, 12]
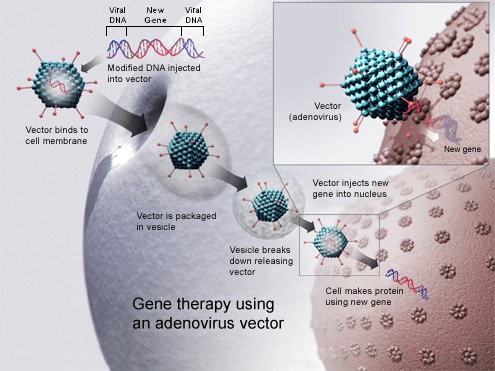
Figuur 3. Gentherapie door middel van een adenovirusvector.[3]
Met name in de jaren ’90 was er een grote toename in het aantal klinische trials die gebruik maakte van gentherapie. Na de dood van een patiënt en nadat twee patiënten leukemie ontwikkelden na gentherapie stopte deze toename. De laatste tijd lijkt het enthousiasme over gentherapie weer enigszins toe te nemen, nadat recente successen laten zien dat het wel degelijk mogelijk is om ziektes te behandelen door middel van gentherapie.[13-15]
2.2 Huidige stand van de wetenschap
Er bestaat op dit moment nog geen goedgekeurde gentherapie voor de behandeling van kleurenblindheid. In de studies die tot dusver zijn gepubliceerd werd gebruik gemaakt van proefdieren en nog niet van proefpersonen. Enkele van deze studies worden hier kort besproken. Het principe is steeds hetzelfde. Met behulp van een replicatiedeficiënt recombinant adeno-geassocieerd virus (rAAV) als vector kan complementair-DNA (cDNA) van één van de fotopigmentgenen via een subretinale injectie worden afgeleverd aan een deel van de kegeltjes in de retina. De kegeltjes laten zodoende het ontbrekende of defecte fotopigmentgen tot expressie komen (figuur 4).[1]
Muizen bezitten alleen S- en M-kegeltjes en zijn dus dichromatisch, in tegenstelling tot primaten die trichromatisch zijn. Zij kunnen daardoor dus minder goed kleuren onderscheiden, vergelijkbaar met kleurenblindheid bij mensen. Veranderingen in de genen die coderen voor de fotopigmenten zijn essentieel voor de evolutie naar een beter vermogen tot het onderscheiden van kleuren; van dichromaat naar trichromaat, en sommige dieren zelfs naar tetrachromaat (het vermogen om ook ultraviolet licht te zien). Men vermoedt dat uitsluitend veranderingen in de genen voldoende zijn om van di- naar trichromatisch te gaan, zonder dat daarbij veranderingen in het zenuwstelsel of de hersenen noodzakelijk zijn. In 2007 publiceerde Jacobs e.a. [16] resultaten van hun onderzoek naar dit theoretische model in Science. Zij vervingen in een deel van de kegeltjes M-fotopigmentgenen door humaan cDNA L-fotopigmentgenen in het X-chromosoom van enkele muizen. Zodoende kweekte zij genetisch gemodificeerde “knockin”-muizen, heterozygote vrouwtjesmuizen met zowel M- als L-kegeltjes. Deze muizen waren nadien trichromatisch. Hoewel geen gebruik werd gemaakt van gentherapie en ditzelfde resultaat met gentherapie lastiger te bereiken is, toont het wel aan dat genetische manipulatie waarschijnlijk voldoende is om kleurenblindheid te behandelen.
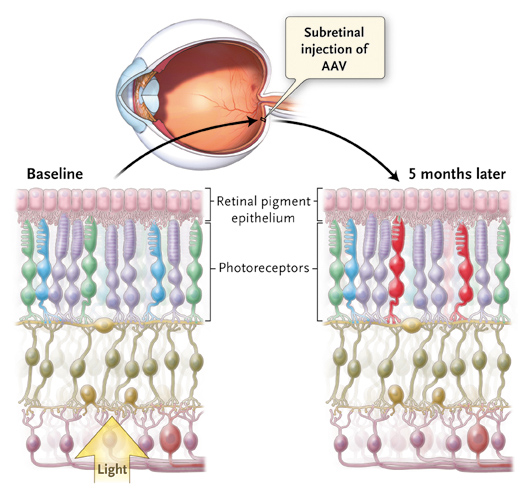
Figuur 4. Introductie en expressie van fotopigmentgenen in de retina door middel van een adenovectorvirus.[1, 2]
Een jaar later toonde Mauck et al. [17] met een publicatie in Visual Neuroscience aan vanaf wanneer de fotopigmentgenen tot expressie komen en hoelang de genexpressie duurt. Met behulp van een recombinant adeno-geassocieerd virus (rAAV) werden een groen-fluorescent proteïne en humane regulator genen (LCR- en promotorgenen) geïnjecteerd in de retina van woestijnratten. De humane regulator genen zorgen ervoor dat de genexpressie alleen plaatsvindt in een subpopulatie van de kegeltjes en niet in de staafjes of andere cellen in de retina. Genexpressie werd voor het eerst te gemeten 14 dagen na injectie, bereikte een piek na 3 maanden en was tot meer dan een jaar nog voldoende hoog. In datzelfde jaar onderzochten Komáromy et al. [18] welke promotors voor de rode fotopigmentgenen het meest effectief en specifiek waren.
Een studie van Mancuso e.a. [2], in 2009 gepubliceerd in Nature, toont aan hoe gentherapie mogelijk kan worden ingezet als behandeling van rood-groene kleurenblindheid (protanopie). Een rAAV met een L-opsinegen en een promotorgen werd geïnjecteerd op de retina van doodshoofdaapjes. Het gen kwam tot expressie in 15-36% van de kegeltjes en na ongeveer 20 weken waren de apen in staat de kleuren rood en groen als afzonderlijke kleuren te herkennen. Bovendien toonde de onderzoekers aan dat de behandeling ook bruikbaar kan zijn bij volwassenen. Voorheen werd gedacht dat in de jeugd in de hersenen neurale circuits worden aangelegd, die niet in staat zijn nieuwe kleuren te herkennen. Deze vorm van gentherapie zou in dat geval alleen kunnen werken als het op zeer jonge leeftijd wordt aangeboden.
Ook op het gebied van achromatopsie werden diverse onderzoeken gedaan, zoals door Pang et al. [19], die in opzet en resultaat vergelijkbaar zijn met de studie van Mancuso et al. hierboven. Ook zij lieten zien dat de kegeltjesfunctie (in dierenmodellen) volledig kan worden hersteld. Komáromy et al. [20] gebruikte twee konijnenmodellen met CNGB3 achromatopsie en ontdekte dat het therapeutisch effect niet afhangt van de mutatie, maar van de gebruikte promotor en de leeftijd van het proefdier. In jongere dieren werd zelfs 33 maanden lang een stabiel therapeutisch effect gemeten. Carvalho et al. [21] bevestigde dit in een muismodel met een identieke vorm van achromatopsie.
2.3 Uitdagingen voor de toekomst
Hoewel gentherapie al enige jaren bekend staat als een veelbelovende behandelvorm voor de toekomst, blijven grote doorbraken tot dusverre uit. Een goed voorbeeld hiervan is de ontwikkeling van gentherapie voor cystische fibrose, een recessief overerfbare ziekte waarbij slijm dat op diverse plaatsen in het lichaam wordt afgescheiden, abnormaal taai is. In 1989 werd het cystic-fibrosis transmembrane regulator-gen (CFTR) ontdekt, het gen dat cystische fibrose veroorzaakt, en men verwachtte binnen enkele jaren een gentherapie te ontwikkelen die de ziekte kon genezen. Nu bijna 25 jaar later is er nog altijd geen goedgekeurde toepassing van gentherapie voor deze ziekte beschikbaar. De belangrijkste redenen hiervoor zijn het ontbreken van kennis van het precieze ziektemechanisme en de structuur van het CFTR-eiwit, en het ontbreken van goede dierenmodellen om onderzoek mee te doen. Toch heeft het onderzoek hiernaar veel kennis en technieken opgeleverd, die ook bij de behandeling van andere ziektes gebruikt worden.[22]
Uit de voorbeelden in de vorige paragraaf blijkt dat de wetenschap technisch ver genoeg is om gentherapie voor de behandeling van kleurenblindheid bij mensen in een klinische trial te gaan onderzoeken. Toch zijn er nog enkele belangrijke redenen die dit in de weg staan.[1]
- Veiligheid en effectiviteit – De manier waarop de virusvector wordt aangeboden aan de retina, door een injectie in het oog, is behalve ingrijpend en onplezierig voor de patiënt ook risicovol. Het oog kan beschadigd raken en er kunnen ontstekingen ontstaan. De effectiviteit van deze vorm van gentherapie is op dit moment nog net bekend, maar waarschijnlijk zijn herhalingsinjecties na verloop van tijd nodig. Dit brengt het risico met zich mee dat het immuunsysteem een afweerreactie op gang brengt tegen de virusvector. Dit kan gevolgen hebben voor de patiënt en voor de effectiviteit van de behandeling.
- Ethiek – Mildere vormen van kleurenblindheid komen met zo’n grote frequentie in de mens voor, dat men zich kan afvragen of het wel gaat om een ziekte of dat er eerder sprake is van een afwijkend fenotype. Ook de mate waarin behandelde personen gaan profiteren van deze therapie is nog niet bekend, mogelijk vermindert de kwaliteit van leven zelfs na de behandeling.
Vooralsnog lijkt het er dus op dat een klinische toepassing van gentherapie voor de behandeling van kleurenblindheid niet in de nabije toekomst verwacht kan worden.
Conclusie
Gentherapie wordt al vele jaren aangekondigd als veelbelovende techniek voor de behandeling van verschillende ziektes, waaronder congenitale kleurenblindheid. Door vele tegenslagen en moeilijkheden bij de ontwikkeling van deze therapie blijven grote doorbraken echter uit. Toch laten recente successen zien dat het wel degelijk mogelijk is om ziektes te behandelen door middel van gentherapie. Inmiddels is overtuigend aangetoond dat gentherapie in de retina, zonder veranderingen in het zenuwstelsel en de hersenen, al mogelijk kan zijn voor de behandeling van kleurenblindheid, ongeacht de leeftijd waarop dit wordt aangeboden. Er bestaat op dit moment nog geen goedgekeurde toepassing van gentherapie voor kleurenblindheid. In de studies die tot dusver zijn gepubliceerd werd gebruik gemaakt van dieren en niet van proefpersonen. Ook is er nog geen geregistreerde klinische trial die gebruik maakt van proefpersonen. De stand van de wetenschap is op technisch gebied ver genoeg, maar vragen over veiligheid, effectiviteit, alsook ethische vraagstukken, zijn nog onvoldoende beantwoord. Gentherapie is op dit moment dus nog geen reële optie voor de behandeling van kleurenblindheid bij mensen. Een goedgekeurde gentherapeutische behandeling van kleurenblindheid kan ook in de nabije toekomst nog niet worden verwacht.
Referenties
- Bennett, J., Gene therapy for color blindness. N Engl J Med, 2009. 361(25): p. 2483-4.
- Mancuso, K., et al., Gene therapy for red-green colour blindness in adult primates. Nature, 2009. 461(7265): p. 784-7.
- Gene therapy using an Adenovirus vector 2005 [cited 2012 17-04]; Available from: http://en.wikipedia.org/wiki/File:Gene_therapy.jpg.
- Spectral absorption curves of the short (S), medium (M) and long (L) wavelength pigments in human cone and rod (R) cells. 2007 [cited 2012 17-04]; Available from: http://en.wikipedia.org/wiki/File:Cone-response.svg.
- Simunovic, M.P., Colour vision deficiency. Eye (Lond), 2010. 24(5): p. 747-55.
- Sung, C.H. and J.Z. Chuang, The cell biology of vision. J Cell Biol, 2010. 190(6): p. 953-63.
- Neitz, J. and M. Neitz, The genetics of normal and defective color vision. Vision Res, 2011. 51(7): p. 633-51.
- Deeb, S.S., The molecular basis of variation in human color vision. Clin Genet, 2005. 67(5): p. 369-77.
- Sheridan, C., Gene therapy finds its niche. Nat Biotechnol, 2011. 29(2): p. 121-8.
- Friedmann, T., A brief history of gene therapy. Nat Genet, 1992. 2(2): p. 93-8.
- Giacca, M. and S. Zacchigna, Virus-mediated gene delivery for human gene therapy. J Control Release, 2012. 161(2): p. 377-88.
- Rots, M.G., et al., Targeted cancer gene therapy: the flexibility of adenoviral gene therapy vectors. J Control Release, 2003. 87(1-3): p. 159-65.
- Ferrua, F., I. Brigida, and A. Aiuti, Update on gene therapy for adenosine deaminase-deficient severe combined immunodeficiency. Curr Opin Allergy Clin Immunol, 2010. 10(6): p. 551-6.
- LeWitt, P.A., et al., AAV2-GAD gene therapy for advanced Parkinson’s disease: a double-blind, sham-surgery controlled, randomised trial. Lancet Neurol, 2011. 10(4): p. 309-19.
- Kohn, D.B. and F. Candotti, Gene therapy fulfilling its promise. N Engl J Med, 2009. 360(5): p. 518-21.
- Jacobs, G.H., et al., Emergence of novel color vision in mice engineered to express a human cone photopigment. Science, 2007. 315(5819): p. 1723-5.
- Mauck, M.C., et al., Longitudinal evaluation of expression of virally delivered transgenes in gerbil cone photoreceptors. Vis Neurosci, 2008. 25(3): p. 273-82.
- Komaromy, A.M., et al., Targeting gene expression to cones with human cone opsin promoters in recombinant AAV. Gene Ther, 2008. 15(14): p. 1049-55.
- Pang, J.J., et al., Achromatopsia as a potential candidate for gene therapy. Adv Exp Med Biol, 2010. 664: p. 639-46.
- Komaromy, A.M., et al., Gene therapy rescues cone function in congenital achromatopsia. Hum Mol Genet, 2010. 19(13): p. 2581-93.
- Carvalho, L.S., et al., Long-term and age-dependent restoration of visual function in a mouse model of CNGB3-associated achromatopsia following gene therapy. Hum Mol Genet, 2011. 20(16): p. 3161-75.
- Pearson, H., Human genetics: One gene, twenty years. Nature, 2009. 460(7252): p. 164-9.
Bovenstaand artikel is geschreven door Ronnie Schuurbiers in het kader van de minor Disciplines Applied Science van de Fontys Hogescholen. Deze tekst mag in geen geval zonder uitdrukkelijke toestemming worden verspreid.

No Comments